Модель атома Резерфорда является одной из первых попыток описать строение атома и объяснить наблюдаемые физические явления. Созданная в 1911 году Ньютоном Резерфордом, она заложила основы для последующего развития и понимания электронной оболочки атома.
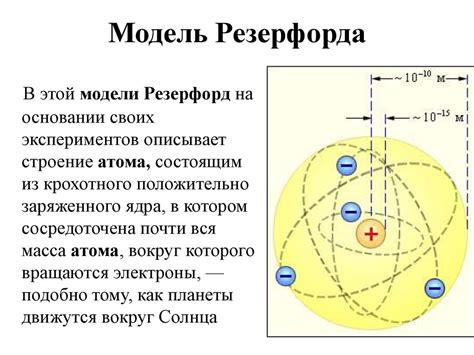
Модель Резерфорда представляла атом как маленькую положительно заряженную частицу - ядро, вокруг которого двигались электроны. Ядро атома состояло из протонов и нейтронов, а электроны находились на некотором расстоянии от ядра.
Название "модель атома Резерфорда" получила в честь учёного, который провёл серию экспериментов по рассеянию альфа-частиц на фольге. Эксперименты показали, что альфа-частицы могут расходиться в разные стороны и проходить сквозь атом, что противоречило модели Томсона. Резерфорд предложил новую модель атома, которая объясняла эти результаты.
Модель атома Резерфорда: определение и сущность
Модель атома Резерфорда, также известная как планетарная модель атома, была предложена физиком Эрнестом Резерфордом в 1911 году. Эта модель развивалась на основе работы Джозефа Джона Томсона, который открыл электрон и предложил модель "арахиса" атома.
Главная идея модели Резерфорда состоит в следующем: атом представляет собой плотное ядро, вокруг которого вращаются электроны подобно планетам, обращающимся вокруг солнца. Ядро атома содержит положительно заряженные протоны и нейтроны, которые сосредоточены в центре и образуют его массу. Электроны, имеющие отрицательный заряд, образуют оболочку вокруг ядра и имеют малую массу по сравнению с ядром.
Модель атома Резерфорда была предложена на основе экспериментов с рассеянием альфа-частиц, которые позволили установить, что атом состоит в основном из пустого пространства, в котором находится маленькое и плотное ядро. Эта модель была первой попыткой объяснить строение атома и стала одной из основополагающих теорий в области атомной физики.
Однако, несмотря на свою значимость, модель Резерфорда имеет некоторые недостатки. Одним из них является отсутствие объяснения стабильности атома, так как электроны, обращающиеся вокруг ядра, должны были постепенно терять энергию и упасть на ядро. Этот недостаток был позднее преодолен с помощью разработки квантовой механики и более совершенных моделей атома.
Эксперимент Резерфорда: открытие неожиданной структуры атома
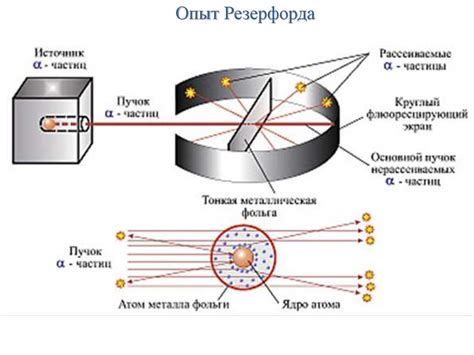
Модель атома Резерфорда, также известная как планетарная модель атома, была предложена Нильсом Бором в 1913 году. Однако, это было непосредственное следствие работ Ъозлея Резерфорда, проведенных в период 1909-1911 годов. Эксперимент Резерфорда, известный как "эксперимент с золотой фольгой", явился ключевым для сформулирования новой модели атома.
Резерфорд и его коллеги провели эксперимент, направляя поток альфа-частиц (ядра гелия) на тонкую фольгу из золота. Ожидалось, что альфа-частицы пройдут через фольгу, разбиваясь на части при столкновении с атомами. Однако, результаты эксперимента оказались неожиданными.
Большинство альфа-частиц проходило сквозь фольгу без изменений в направлении. Но к многим из них проявлялись отклонения под небольшими углами. Иногда альфа-частицы даже отскакивали назад, попадая в обратную сторону от первоначального направления. Это указывало на то, что атомы имели некую неожиданную структуру.
На основе этих результатов, Резерфорд предложил модель, согласно которой атом состоит из маленького и плотного ядра в центре, вокруг которого вращаются электроны на определенных орбитах. Это объясняло, почему большая часть альфа-частиц пролетала через фольгу без изменений в направлении - они проходили мимо электронов и попадали в пространство между ними и ядром. Однако, отклонения и отразившиеся альфа-частицы говорили о том, что сами атомы имеют некую положительную заряженность в своем центре - ядро.
Модель Резерфорда была одной из первых попыток объяснить структуру и состав атомов, и она положила начало развитию науки в этой области. Однако, позднее были сделаны новые открытия, и модель Бора была усовершенствована и заменена более сложными и точными теориями, такими как квантовая механика.
Тем не менее, эксперимент Резерфорда и модель, основанная на его результате, сыграли важную роль в понимании атомной структуры и стали отправной точкой для дальнейших исследований и открытий в области ядерной физики и атомной энергии.
Строение модели Резерфорда: об основных элементах
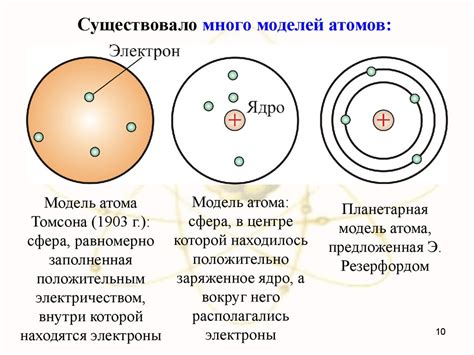
В модели Резерфорда атом представлялся как миниатюрная Солнечная система. Обычно эту модель также называют моделью "планетарного атома". Основные элементы этой модели включают:
1. Ядро.
В центре атома находится ядро. Это маленький и плотный объект, который содержит почти всю массу атома. Ядро состоит из положительно заряженных протонов и не имеет электрических зарядов.
2. Электроны.
Электроны - это отрицательно заряженные частицы, которые вращаются вокруг ядра на определенных орбитах, подобно планетам, вращающимся вокруг Солнца. Они находятся в постоянном движении и создают электростатическое поле.
3. Орбиты.
Электроны в модели Резерфорда движутся по определенным орбитам вокруг ядра. Орбиты электронов должны быть целыми числами, но они не могут быть непрерывными. Вместо этого электроны занимают только определенные уровни энергии или орбиты, на которых сохраняются.
Модель Резерфорда помогла объяснить некоторые явления, такие как отражение альфа-частиц от тонких пленок и различия в рассеянии альфа-частиц под разными углами. Впоследствии эта модель была заменена более точными и сложными моделями, такими как модель Шрёдингера, но она остается важным вехой в развитии нашего понимания строения атома.
Почему модель Резерфорда называется "планетарной"?

Модель атома, предложенная Нильсом Бором, получила название "планетарной" благодаря своему сходству с солнечной системой. В этой модели атом представляется в виде ядра, вокруг которого вращаются электроны, подобно планетам, движущимся вокруг Солнца.
Нильс Бор предложил эту модель атома, чтобы объяснить некоторые несоответствия тогдашней модели Резерфорда. По модели Резерфорда атом представлял собой положительно заряженное ядро, вокруг которого электроны движутся по орбитам. Однако, по экспериментальным данным, такая модель не могла объяснить, как атом может оставаться устойчивым и почему электроны не теряют энергию и не спирализируют в ядро.
Модель Бора предложила новый взгляд на строение атома. Она предполагает, что электроны могут находиться только на определенных энергетических уровнях, и устойчивые орбиты имеют фиксированную энергию. Поэтому они не теряют энергию и не спирализируют в ядро.
Такая модель атома схожа с планетарной системой, где электроны вращаются по фиксированным орбитам, подобно планетам, которые движутся вокруг Солнца. Это сравнение привело к называнию модели Бора "планетарной".
Модель Резерфорда имела существенные недостатки, но она заложила основу для развития более точных и улучшенных теорий атомного строения. Модель Бора стала первым шагом к пониманию квантовой физики и открытию более сложной структуры атома.
Бедность модели Резерфорда: причины и ограничения

Одна из главных причин бедности модели Резерфорда заключается в отсутствии объяснения стабильности атома. Согласно классической электродинамике, электроны, обращающиеся по орбитам, должны испускать энергию в виде электромагнитного излучения и, в конечном счете, должны упасть на ядро. Однако это противоречит наблюдаемой стабильности атомов.
Кроме того, модель Резерфорда не объясняла орбитальную структуру атома и возможность существования различных уровней энергии у электронов. Его модель предполагала непрерывное движение электронов по орбитам, в то время как наблюдаемые спектральные линии свидетельствуют об уровневой структуре атома и дискретном излучении и поглощении электромагнитного излучения.
Другая ограниченность модели Резерфорда заключается в отсутствии объяснения причин и механизмов перехода электронов с одной орбиты на другую. В реальности электроны могут поглощать или испускать энергию, изменяя свою орбиту, но в модели Резерфорда такие переходы были непонятными и необъяснимыми.
Эти ограничения и причины бедности модели Резерфорда привели к разработке более сложных и улучшенных моделей атома, таких как модель Бора и квантовая механика, которые объясняют большинство наблюдаемых явлений и являются более точными и полными. Но модель Резерфорда остается важным историческим этапом в развитии нашего понимания атомной структуры и вносит вклад в основы современной физики.
Наследие модели Резерфорда: влияние на развитие атомной физики

Модель атома, предложенная Эрнестом Резерфордом в 1911 году, имела огромное значение для развития атомной физики. Его модель, которая называется часто моделью "кусочка пудинга с изобилующими в нем положительно заряженными частицами", позволила сделать первые шаги в понимании внутренней структуры атомов.
Модель Резерфорда поставила под серьезное сомнение теорию Атома Томсона, согласно которой атом был непрерывным и равномерно распределенным объектом. Вместо этого Резерфорд предложил, что положительная заряженная частица (ядро атома) находится в центре и имеет массу много большую, чем электроны, которые вращаются вокруг ядра.
Модель Резерфорда имела ряд ограничений и была позднее заменена моделью Бора, но она была ключевым этапом в развитии атомной физики. Результаты экспериментов, проведенных на основе модели Резерфорда, привели к открытию ионизации вещества, радиоактивности и ядерной энергии.
Кроме того, модель Резерфорда сыграла важную роль в становлении квантовой механики. Несмотря на то, что она была заменена моделью Бора, идеи Резерфорда о нестабильности атомов и наличии подструктур в атомах влияли на развитие квантовой теории.
Таким образом, наследие модели Резерфорда состоит в том, что она положила начало новому этапу в исследовании атома, влияла на понимание внутренней структуры атомов и способствовала развитию квантовой механики.
Значение модели Резерфорда в современной науке

Модель атома Резерфорда, предложенная английским физиком Эрнестом Резерфордом в 1911 году, играла и продолжает играть значительную роль в современной науке.
Значение модели Резерфорда заключается в том, что она представляет первую попытку объяснить внутреннюю структуру атома. Согласно модели Резерфорда, атом состоит из ядра, вокруг которого обращаются электроны на орбитах. Ядро содержит положительно заряженные протоны и несущие нейтральный заряд нейтроны, а электроны имеют отрицательный заряд.
Модель Резерфорда была первым шагом в понимании атомной структуры. Она объясняла такие явления, как отклонение частиц альфа в экспериментах. Открытие ядерных сил и работа с моделью Резерфорда позволили ученым впервые понять процессы, происходящие внутри атома.
Сегодня модель Резерфорда не является полностью точной, но она все еще ценна для понимания атомной физики. Она открыла путь к разработке более сложных и точных моделей, таких как квантовая механика и стандартная модель частиц.
Кроме того, модель Резерфорда имеет практическое применение в области ядерной физики и технологий. Она является основой для различных методов анализа, таких как ядерная спектроскопия и радиоактивные измерения. Также модель Резерфорда была важна для разработки ядерной энергетики и ядерных реакторов.
Таким образом, модель Резерфорда имеет несомненное значение в современной науке. Она помогла ученым разобраться во внутренних процессах атома и открыть новые горизонты в физике и технологии.



