Вода - одно из самых распространенных веществ на Земле и имеет множество уникальных свойств. Одно из таких свойств - ее способность растворять различные вещества. Но почему некоторые вещества растворяются в воде, а другие нет?
Когда мы говорим о растворении, мы имеем в виду процесс, в котором молекулы вещества (растворимого вещества) вступают во взаимодействие с молекулами растворителя (воды) и равномерно распределяются по всему объему раствора. Однако не все вещества имеют способность к такому взаимодействию с водой.
Одной из причин растворимости или нерастворимости веществ в воде является полярность. Водный растворитель, такой как вода, имеет полярные связи, что означает, что в ней есть разделение электрического заряда. В молекуле воды атом кислорода имеет отрицательный заряд, а атомы водорода - положительный заряд.
Вещества, такие как соли и сахар, растворяются в воде, потому что они имеют полярные связи и могут взаимодействовать с полярными молекулами воды. Когда эти вещества растворяются, их молекулы разделяются на ионы и окружающие молекулы воды образуют с ними водородные связи, что позволяет им равномерно распределиться в растворе.
Растворимость веществ в воде: общая информация

Вещества, которые растворяются в воде, называются гидрофильными или поларными. Они обладают полярными связями или имеют заряженные группы, что позволяет им взаимодействовать с полярными молекулами воды. Гидрофильные вещества могут быть в форме ионов, молекул или молекулярных соединений.
Например, соль натрия (NaCl) растворяется в воде, так как ионы натрия (Na+) и хлорида (Cl-) образуют водородные связи с молекулами воды, образуя гидратированные ионы. Это позволяет соли распадаться на ионы и равномерно распределиться в водном растворе.
С другой стороны, вещества, которые не растворяются в воде, называются гидрофобными или неполарными. Они не обладают полярными связями и не способны взаимодействовать с молекулами воды. Примером такого вещества может быть масло, которое при контакте с водой образует отдельные капли, не растворяясь.
Растворимость веществ в воде может быть выражена числовым значением - растворимостью. Растворимость может быть указана в граммах вещества, которое растворяется в 100 миллилитрах воды (г/100 мл). Или в г/литр (г/л), что указывает на количество вещества, растворенного в одном литре воды.
Знание о растворимости веществ в воде имеет большое значение в химии и биологии, так как позволяет понять способность веществ взаимодействовать с водой и оказывать влияние на различные процессы и системы.
Молекулярный уровень
Вода способна образовывать водородные связи соединений с атомами других веществ, что обеспечивает прочное взаимодействие и растворение. Это происходит, когда молекулы воды притягиваются к заряженным частичкам вещества и окружают их, исключая их из кристаллической решетки или молекулярной структуры.
Однако вещества, имеющие неполярные молекулы, не растворимы в воде. Вода не может образовывать водородные связи с неполярными веществами, поэтому они остаются в собственной структуре и не растворяются.
Энергия и растворимость

Растворимость вещества в воде зависит от энергетических характеристик как самого вещества, так и воды. Энергия взаимодействия частиц вещества и воды определяет возможность образования устойчивого раствора.
Полярность - одна из основных характеристик вещества, влияющая на его растворимость в воде. Полярные вещества имеют электрические заряды, что позволяет им образовывать водородные связи с молекулами воды. Неполярные вещества же не имеют электрических зарядов и имеют меньшую способность образовывать связи с водой.
Размер и форма молекулы - также важные факторы, влияющие на растворимость воде. Маленькие молекулы, в основном, имеют большую растворимость, так как они могут эффективно взаимодействовать с молекулами воды. Однако, есть и исключения, когда молекула вещества имеет такую форму или размер, что ее взаимодействие с молекулами воды осложнено.
Таким образом, различные энергетические характеристики вещества и взаимодействие его молекул с молекулами воды определяют его растворимость в данной среде.
Химические свойства веществ

Растворимость - это способность вещества, называемого растворителем, раствориться в другом веществе, называемом раствором. Некоторые вещества хорошо растворяются в воде, например, сахар, соль, кислоты и щелочи. Они образуют гомогенные растворы, где частицы растворенного вещества равномерно распределены по объему раствора.
Другие вещества плохо растворяются в воде или вообще не растворяются. К ним относятся многие газы, жиры, масла и некоторые металлы. Они могут образовывать гетерогенные системы, где растворенное вещество находится в виде частиц, отличных от растворителя.
Кроме растворимости, химические свойства веществ включают их реактивность, термическую устойчивость, окислительно-восстановительные свойства и другие. Реактивность определяет поведение вещества в химических реакциях: оно может быть активным и легко взаимодействовать с другими веществами, или наоборот, быть инертным и не проявлять сильных химических свойств.
Термическая устойчивость показывает, насколько вещество устойчиво к высоким температурам. Некоторые вещества могут выдерживать высокие температуры и не накапливать тепло, в то время как другие могут легко разлагаться или подвергаться химическим изменениям при повышенной температуре.
Окислительно-восстановительные свойства веществ определяют их способность окислять или восстанавливать другие вещества в химических реакциях. Некоторые вещества имеют сильные окислительные свойства и могут вызывать окислительные реакции, когда они вступают в контакт с другими веществами.
Все эти химические свойства веществ определяют их поведение и важны для понимания многих процессов в природе и промышленности.
Роли поларности и неполярности
Полярные вещества обладают полярными молекулами, которые имеют неравномерное распределение зарядов. Это значит, что в таких молекулах существуют заряды разного знака, такие как положительный и отрицательный. Вода является полярным растворителем, поскольку молекулы воды также обладают полярностью. В результате, полярные вещества имеют способность растворяться в воде, поскольку водные молекулы притягивают полярные частицы и образуют с ними взаимодействия.
С другой стороны, неполярные вещества обладают неполярными молекулами, которые имеют равномерное распределение зарядов. Это означает отсутствие разности в зарядах молекулы. Вода не может образовывать взаимодействия с неполярными молекулами, поскольку полярность воды и неполярных веществ не совпадает. В результате, неполярные вещества обычно не растворяются в воде и образуют слои или капли неполярного раствора.
Таким образом, поларность и неполярность существенно влияют на растворимость веществ в воде. Полярные вещества образуют растворы в воде, тогда как неполярные вещества не растворяются и существуют в виде слоев или капель неполярного раствора.
Температура и растворимость
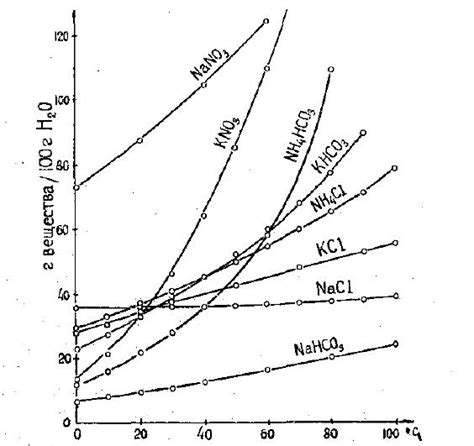
Растворимость вещества в воде зависит от его химического строения, а также от условий окружающей среды, в частности от температуры.
При повышении температуры обычно увеличивается растворимость твердых и газообразных веществ. Это происходит потому, что молекулы вещества при нагревании получают больше энергии и начинают двигаться быстрее. Это позволяет им преодолевать притяжение друг к другу и лучше смешиваться с молекулами воды.
Например, сахар и соль легко растворяются в воде при нагревании. В то же время, некоторые вещества, такие как жирные кислоты и масла, плохо растворимы даже при высоких температурах. Это связано с их химической структурой, которая делает их менее подходящими для взаимодействия с молекулами воды.
Однако есть также исключения из этого правила. Некоторые вещества, например, газы, имеют обратную зависимость растворимости от температуры. При повышении температуры, растворимость газов обычно снижается, поскольку при этом процессе молекулы газа получают больше энергии и начинают выходить из раствора.
Таким образом, температура играет важную роль в процессе растворения веществ в воде. Различия в растворимости могут быть объяснены как химическим составом вещества, так и внешними условиями, включая температуру.
Влияние давления
Давление также может оказывать определенное влияние на растворимость веществ в воде. Высокое давление обычно повышает растворимость веществ, в то время как низкое давление может уменьшить ее.
Когда давление повышается, газы и некоторые другие вещества могут лучше взаимодействовать с молекулами воды и, следовательно, быть лучше растворимыми. Это связано с изменением кинетической энергии молекул и скорости их движения, что способствует созданию более благоприятных условий для образования раствора.
С другой стороны, при низком давлении межмолекулярные взаимодействия между веществами и молекулами воды могут быть ослаблены, что часто приводит к уменьшению растворимости. Это происходит, например, при кипении воды, когда давление над раствором снижается, что может привести к возникновению отделения вещества в виде осадка или испарению раствора.
Влияние давления на растворимость веществ в воде может быть сложным и зависит от ряда факторов, включая тип вещества, температуру и другие условия. Для некоторых веществ давление может иметь незначительное влияние на растворимость, в то время как для других оно может оказывать значительное воздействие.



