Щелочи – это особый тип химических соединений, характеризующихся высоким уровнем щелочности. Они обладают специфическими свойствами, включая способность изменять окраску в зависимости от реагирующих компонентов.
Одним из вариантов изменения окраски раствора щелочи является добавление индикатора. Индикаторы – это вещества, которые в зависимости от кислотности или щелочности раствора могут менять свою окраску. Присутствие индикатора позволяет определить степень щелочности раствора и узнать, является ли он кислотным или щелочным.
Когда раствор щелочи окрашивается после добавления индикатора, это указывает на то, что в реакции происходит заметное изменение pH-уровня раствора. Изначально щелочной раствор может быть безцветным или иметь определенную окраску. Однако, добавление индикатора позволяет увидеть, как изменяется окраска раствора при взаимодействии с другими веществами.
Изменение окраски раствора щелочи
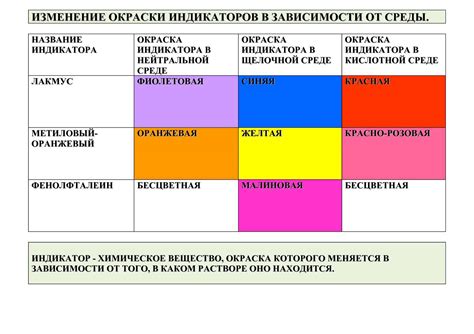
Окраска раствора щелочи может измениться с добавлением индикатора из-за его способности взаимодействовать с щелочными и кислотными веществами. Индикаторы представляют собой вещества, которые меняют свой цвет в зависимости от концентрации водородных ионов в растворе. В щелочной среде щелочные индикаторы, такие как фенолфталеин и метилоранж, чаще всего приобретают розовую или красную окраску. Наоборот, в кислой среде они обычно сохраняют свою первоначальную окраску или приобретают другой цвет, например, желтый или красный.
Окраска раствора щелочи изменяется из-за того, что индикатор вступает в реакцию с щелочной средой и образует новые соединения с другими цветами. Это происходит из-за изменения в концентрации водородных ионов. Значение pH щелочного раствора возрастает после добавления щелочного индикатора, вызывая изменение его окраски.
Изменение окраски раствора щелочи с добавлением индикатора является важным инструментом в химическом анализе и используется для определения pH-значения растворов. Кроме того, изменение окраски может также быть полезным при проведении различных экспериментов и в процессе производства лекарственных препаратов, пищевых продуктов и других химической продукции.
Взаимодействие щелочи и индикатора

Окраска раствора щелочи может меняться с добавлением индикатора из-за химической реакции, происходящей между ними.
Щелочи являются основаниями и обладают высоким уровнем рН. Индикаторы, с другой стороны, являются органическими соединениями, которые способны изменять свой цвет в зависимости от кислотно-щелочного состояния раствора.
При добавлении индикатора в раствор щелочи происходит взаимодействие между щелочью и индикатором. Индикатор реагирует с ОН-ионами, присутствующими в щелочном растворе, и образует комплексы, которые могут иметь различную окраску. Это объясняет изменение цвета раствора щелочи после добавления индикатора.
Окраска индикатора зависит от его химического состава и структуры, а также от свойств добавленной щелочи. Различные индикаторы имеют разную чувствительность к щелочным растворам и могут демонстрировать разные цвета в различных концентрациях и типах щелочей.
Таким образом, окраска раствора щелочи меняется с добавлением индикатора из-за их химического взаимодействия, которое приводит к образованию цветных комплексов. Это особенно полезно при выполнении различных химических исследований и лабораторных работ, где необходимо определить точку окраски или pH-уровень раствора.
Эффект на физический уровень
Раствор щелочи меняет свою окраску с добавлением индикатора из-за физико-химических процессов, которые происходят между двумя веществами.
Индикаторы являются химическими соединениями, которые изменяют свой цвет в зависимости от pH-значения раствора. Когда мы добавляем индикатор в раствор щелочи, происходят реакции между индикатором и ионами гидроксила, которые присутствуют в щелочном растворе. В результате этих реакций образуются новые соединения, которые имеют различную окраску.
На примере бромтимолового синего:
В щелочном растворе бромтимоловый синий приобретает синий цвет из-за образования комплекса с ионами гидроксила. Происходит замещение кислородного атома азотного ядра бромтимолового синего на водородный атом, что приводит к изменению электронной структуры и, следовательно, к изменению цвета.
Таким образом, добавление индикатора в раствор щелочи позволяет наглядно оценить изменение pH-значения этого раствора. Меняющаяся окраска является результатом сложных физико-химических процессов, которые происходят на уровне молекул и атомов.
Химическое действие индикатора

Окраска раствора щелочи изменяется с добавлением индикаторов в результате химических реакций, происходящих между индикатором и самым раствором. Индикаторы обладают свойством менять свой цвет в зависимости от pH-значения среды или наличия определенного химического соединения.
Например, универсальный индикатор, такой как фенолфталеин, окрашивает щелочной раствор в розовый цвет. Это происходит из-за реакции фенолфталеина с щелочью, приводящей к образованию окрашенного комплекса. Если добавить кислоту в раствор с фенолфталеином, цвет изменится на безцветный или желтый, так как реагент реагирует с кислотой и образует другой комплекс, который не окрашен.
Химическое взаимодействие индикаторов с растворами может быть обращаемым или необратимым, в зависимости от типа индикатора и условий реакции. Кроме того, различные индикаторы имеют определенные диапазоны pH-значений, при которых они меняют цвет, что позволяет использовать их для определения различных условий среды.
Спектральные свойства индикаторов
Основной механизм, лежащий в основе изменения окраски индикаторов, – это отображение разности энергии света, поглощаемого веществом. Каждый индикатор обладает определенным спектральным свойством, которое определяет его способность поглощать и отражать свет в зависимости от pH окружающей среды.
Вещество, имеющее цвет, способно поглощать энергию света определенной длины волны. Если длина волны попадает в спектральный диапазон, в котором индикатор способен поглощать свет, возникает резонансное поглощение, что приводит к изменению его электронной конфигурации.
- При поглощении света индикатор переходит из ненаправленного (сильно поглощающего) состояния в направленное (сильно отклоняющее).
- Когда индикатор не поглощает или слабо поглощает свет, его окраска не меняется.
- Максимальная разница в энергии поглощаемых и отражаемых веществом световых фотонов приводит к ярко выраженной смене цвета индикатора.
Спектральные свойства индикаторов зависят от их структуры и наличия так называемых цветовых групп, которые обладают способностью абсорбировать свет определенной длины волны. Изменяя pH-уровень раствора, меняется и электронное строение индикатора, в результате чего меняется его спектральное свойство и, соответственно, цвет.
Изучение спектральных свойств индикаторов позволяет использовать их для качественного и количественного анализа по определению pH-значения растворов и других показателей их состояния.
Молекулярная структура индикаторов
Молекулярная структура индикаторов имеет ключевое значение для понимания их работы. Обычно индикаторы состоят из сложных органических молекул, которые могут менять свое электронное строение в зависимости от кислотно-щелочного баланса среды.
Основу молекулы индикатора образует ароматическое кольцо, часто содержащее конъюгированную систему двойных связей. Именно эта особенность позволяет индикатору поглощать свет определенных длин волн и изменять свой окрас в зависимости от окружающей среды.
Добавление индикатора к раствору щелочи вызывает изменение окраски раствора. Щелочное окружение приводит к образованию ионов гидроксида, которые могут взаимодействовать с молекулами индикатора. Это взаимодействие приводит к изменению электронного строения молекулы и, соответственно, изменению ее способности поглощать и переизлучать свет определенной длины волны.
В результате, окраска раствора щелочи меняется в зависимости от концентрации гидроксидных ионов. Например, индикатор фенолфталеин имеет молекулярную структуру, которая обеспечивает его безцветность в кислой среде и ярко-розовую окраску в щелочной среде.
Таким образом, молекулярная структура индикаторов и их способность реагировать на изменения кислотно-щелочного баланса являются основными факторами, определяющими изменение окраски раствора щелочи при добавлении индикатора.
Взаимодействие с кислыми и основными ионами

Окраска раствора щелочи может меняться с добавлением индикатора из-за взаимодействия щелочных ионов с кислыми или основными ионами в растворе. Когда в раствор щелочи добавляют индикатор, происходит химическая реакция между индикатором и ионами в растворе. Результатом этой реакции может быть изменение окраски раствора.
Кислые ионы могут привносить кислотность в раствор щелочи и вызывать изменение цвета индикатора. Например, индикатор мог быстро окраситься в кислотную окраску при взаимодействии с кислыми ионами. Основные ионы, с другой стороны, могут нейтрализовать щелочь и изменить ее характеристики, включая цвет индикатора.
Таким образом, взаимодействие с кислыми и основными ионами в растворе щелочи может оказывать влияние на окраску раствора и изменять его химические свойства. Поэтому добавление индикатора может помочь определить кислотность или щелочность раствора и визуально показать изменение его характеристик.
Реакции окислительно-восстановительных процессов

Окислительно-восстановительные реакции представляют собой химические реакции, в которых происходит передача электронов между веществами. В реакциях окисления одно из веществ теряет электроны (становится окисленным), а в реакциях восстановления одно из веществ получает электроны (становится восстановленным).
Когда в раствор щелочи добавляется индикатор, происходят окислительно-восстановительные реакции между индикатором и веществами, находящимися в растворе. При этом меняется окраска раствора.
Индикаторы растворяются в воде и могут образовывать разные формы: оксид, оксоанион или оксоанион-карбонильный комплекс. Как правило, каждая форма имеет свою окраску. Взаимодействие индикатора с веществами в растворе может изменять его окислительное состояние и, соответственно, окраску.
Например, при добавлении индикатора к раствору щелочи может происходить окисление или восстановление одного из компонентов раствора. Это приводит к изменению его окраски.
Таким образом, окраска раствора щелочи изменяется с добавлением индикатора из-за окислительно-восстановительных процессов, происходящих между индикатором и веществами в растворе.
Реакции с разными средами

Окраска раствора щелочи может меняться с добавлением индикатора, потому что индикаторы реагируют с разными средами растворов.
Когда добавляется щелочной раствор, индикатор может изменить свой цвет в зависимости от его pH-значения. Некоторые индикаторы окрашиваются в кислой среде, другие - в щелочной. Это связано с их структурой и способностью взаимодействовать с протонами в растворе.
Добавление индикатора в щелочной раствор может привести к следующим реакциям:
- Индикатор может изменить свой цвет и стать более ярким или насыщенным.
- Индикатор может изменить свой цвет и стать менее ярким или бледным.
- Индикатор может образовать осадок или выпасть в осадок.
- Индикатор может изменить свою форму или структуру.
Эти изменения в цвете или свойствах индикатора позволяют наблюдать визуальные изменения в растворе щелочи. Таким образом, использование индикатора позволяет определить pH-значение раствора и оценить его щелочность или кислотность.
Кинетика окраски растворов щелочей

Окраска раствора щелочи может изменяться с добавлением индикатора из-за изменения кислотно-щелочного равновесия и скорости химической реакции. Раствор щелочи имеет основный характер и обладает высоким рН значением. Индикаторы, добавляемые в раствор, оказывают влияние на молекулы вещества, изменяя его окраску.
Добавление индикатора идет в два этапа:
- При первоначальном погружении индикатора в раствор происходит его ионизация, растворение и диссоциация частиц. Этот процесс может занимать некоторое время и влияет на образование равновесного состояния в системе.
- После установления равновесия начинается окрашивание раствора, что сопровождается изменением цвета. Данный процесс связан с взаимодействием индикатора и щелочи. В результате протекающих химических реакций образуется окрашенный комплекс, который выражается в изменении цвета раствора.
Скорость окраски раствора щелочи индикатором зависит от нескольких факторов:
- Концентрации индикатора в растворе. Чем выше концентрация индикатора, тем быстрее окрашивание раствора будет происходить;
- Температуры раствора. При повышении температуры скорость окраски может увеличиваться;
- Щелочности раствора. Раствор щелочи может содержать различные ионы, которые могут влиять на кинетику окраски и изменение цвета.
Таким образом, добавление индикатора в раствор щелочи приводит к изменению окраски раствора из-за изменения кислотно-щелочного равновесия и образования окрашенного комплекса. Кинетика окраски зависит от концентрации индикатора, температуры и щелочности раствора.
Практическое применение использования индикаторов

Индикаторы широко используются в химической аналитике и других областях для определения концентрации и степени окисления-восстановления различных веществ. Индикаторы позволяют наглядно показать изменение pH раствора путем изменения цвета.
Также, в быту можно встретить применение индикаторов, например, при проверке качества питьевой воды. Индикатор добавляется в образец воды, и его окраска позволит определить наличие или отсутствие примесей или загрязнений.
В медицинской практике индикаторы используются для контроля pH в телесных жидкостях, таких как кровь или моча. Они помогают диагностировать различные заболевания или состояния организма.
Индикаторы также находят применение в пищевой промышленности. Они используются для определения степени спелости фруктов и овощей, а также для контроля окислительно-восстановительных свойств различных продуктов.
| Преимущества использования индикаторов: |
|---|
| Наглядное отображение изменения pH раствора |
| Определение точки эквивалентности при титровании |
| Быстрая и удобная диагностика в медицинской практике |
| Контроль качества пищевых продуктов |
Использование индикаторов является важным инструментом для определения химических свойств и состава веществ. Они позволяют не только производить анализ, но и предоставлять важную информацию о физических и химических изменениях.



