Метан и силан являются представителями группы органических соединений, которые являются важными с точки зрения химической промышленности и исследований. Однако, несмотря на сходство в их структуре и физических свойствах, они обладают существенными различиями в устойчивости на воздухе.
Метан – это самый простой углеводород, в составе которого находится только один атом углерода и четыре атома водорода. Метан имеет бесцветную и безвкусную газообразную форму и широко используется в качестве топлива. Несмотря на свою неактивность, метан является высоко горючим и может образовывать взрывоопасные смеси с воздухом.
Силан, в свою очередь, также является газообразным веществом, который состоит из кремния и водорода. Этот соединенный элемент является одним из самых распространенных в природе и используется в различных промышленных процессах. В отличие от метана, силан является более реакционным соединением и обладает специфическим запахом.
Метан: основные свойства и химическая структура
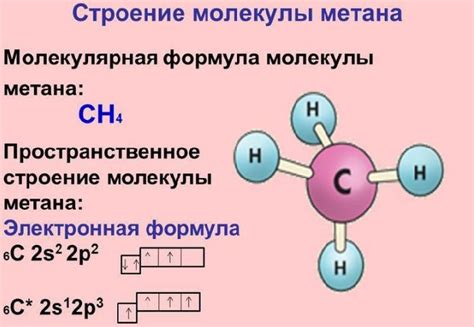
Метан является безцветным газом без запаха при нормальных условиях. Он является одним из наиболее распространенных газов в природе и является главным компонентом природного газа.
Основные свойства метана включают высокую горючесть, низкую токсичность и неполноценность взрывчатых свойств. Он может гореть в воздухе при наличии источника воспламенения, образуя кислородное огнеупорное пламя и выделяя воду и углекислый газ.
Метан занимает важное место в различных отраслях промышленности, включая производство электроэнергии, отопление и химическую промышленность. Он также является значимым фактором в проблеме парникового эффекта, так как является сильным парниковым газом.
Силан: особенности и состав молекулы
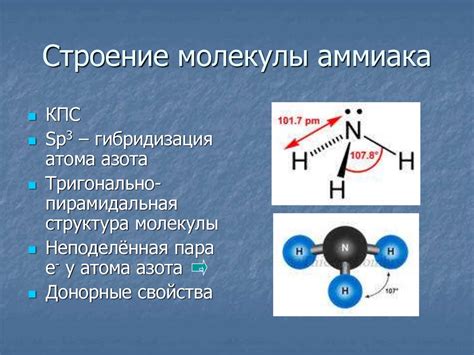
Основная особенность силана заключается в его реакционной способности с кислородом воздуха. При контакте с кислородом силан начинает окисляться, образуя силикаты, гидроксиды и другие соединения. Это приводит к плохой устойчивости силана на воздухе.
Другая особенность силана связана с его положительными свойствами как реагента в химических реакциях. Благодаря наличию кремния, силан может использоваться в различных промышленных процессах, включая производство силиконов, стекла и полупроводников. Кроме того, силан обладает хорошей диффузионной способностью, что позволяет ему проникать внутрь различных твердых материалов и улучшать их качество и свойства.
Молекула силана состоит из одного атома кремния и четырех атомов водорода, связанных с кремнием координационными связями. Кремний - это полупроводниковый элемент, который обладает высокой активностью и электроотрицательностью. Водородные атомы, связанные с кремнием, образуют ковалентные связи.
Важно отметить, что силан является газообразным веществом при комнатной температуре и давлении. Он имеет характерный запах и является легким воспламеняющимся газом. Из-за своей огнеопасности и реакционной способности силан требует особых условий хранения и использования.
Факторы, влияющие на устойчивость воздуху

Устойчивость воздуху метана и силана обусловлена рядом факторов:
- Химическая структура молекулы. Метан – это простейший углеводород, состоящий из одного атома углерода и четырех атомов водорода. Благодаря этой простой структуре, он обладает высокой устойчивостью на воздухе. Силан, с другой стороны, содержит кремний вместо углерода, и его структура более сложна, что делает его менее устойчивым в атмосфере.
- Силан имеет большую реакционную способность по сравнению с метаном, что также влияет на его устойчивость на воздухе. Он может проявлять взрывоопасность, если не был должным образом обработан и сохранен. Метан, в свою очередь, обладает низкой химической активностью и обычно не образует взрывоопасных смесей с воздухом.
- Температура окружающей среды может влиять на устойчивость воздуху метана и силана. Высокие температуры могут способствовать химическим реакциям и разложению силана, что делает его менее устойчивым. Метан же остается устойчивым при высоких температурах в силу своей химической структуры.
- Среда, в которой находятся метан и силан, также влияет на их устойчивость на воздухе. Присутствие окислителей может привести к окислительной реакции с метаном или силаном, что снижает их устойчивость. Кроме того, силан может быть реакционен с водой, поэтому влажность воздуха может также влиять на его устойчивость.
В целом, устойчивость воздуху метана и силана определяется их химическими свойствами, внешними условиями и взаимодействием с окружающей средой.
Окисление: реакция метана и силана с кислородом
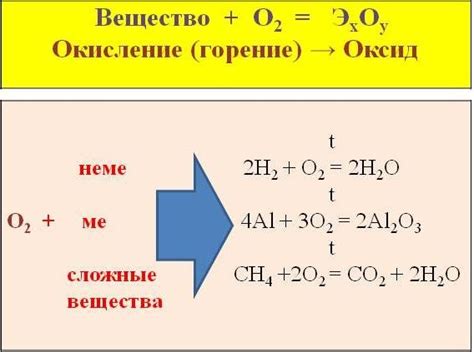
Метан, химическая формула CH4, является наиболее простым углеводородом и основным компонентом природного газа. Взаимодействие метана с кислородом происходит при высоких температурах, в присутствии искры или открытого пламени. В результате окисления образуются углекислый газ (CO2) и вода (H2O). При данных условиях такая реакция протекает достаточно быстро, поэтому метан является весьма горючим веществом.
Силан, химическая формула SiH4, является газообразным соединением кремния. Взаимодействие силана с кислородом также может привести к его окислению, но при комнатных температурах эта реакция является медленной и в значительной степени неспецифичной. В результате окисления силана образуются аморфный диоксид кремния (SiO2) и вода (H2O). Однако, наличие нескольких водородных атомов в молекуле силана делает его более реакционноспособным, чем метан, и способным к горению при определенных условиях.
Таким образом, разница в устойчивости метана и силана на воздухе обусловлена их различными химическими свойствами и скоростью окисления. Метан окисляется сразу и образует углекислый газ и воду, в то время как силан окисляется медленно и образует аморфный диоксид кремния и воду. Эта разница в химическом поведении делает метан более устойчивым на воздухе по сравнению с силаном.
| Вещество | Реакция с кислородом | Результат окисления |
|---|---|---|
| Метан (CH4) | CH4 + 2O2 → CO2 + 2H2O | Образование углекислого газа и воды |
| Силан (SiH4) | 4SiH4 + O2 → 4SiO2 + 2H2O | Образование диоксида кремния и воды |
Воздействие влаги: реакция метана и силана с водой

Метан, представляющий собой простейший представитель углеводородов, является невоспламеняемым газом и не реагирует с водой при обычных условиях. Взаимодействие метана с водой возможно только при высоких температурах и давлениях, когда происходит его гидрирование. Гидрированный метан применяется в процессе производства водорода.
В отличие от метана, силаны являются реактивными соединениями и могут реагировать с водой даже при нормальных условиях. В результате воздействия влаги на силаны, происходит гидролиз, в результате которого образуется водород и соответствующие кремневые оксиды. Реакция между силанами и водой является экзотермической и может протекать с выделением тепла.
Таким образом, реакция метана и силана с водой различна, причем метан не реагирует с водой при обычных условиях, а силаны могут гидролизоваться уже при контакте с влажностью. Это связано с различными энергетическими свойствами данных соединений.
Фотолиз: влияние солнечного излучения
При фотолизе, энергия света, поглощенная молекулами метана и силана, инициирует химическую реакцию, которая приводит к их дальнейшему разложению. Солнечное излучение содержит ультрафиолетовые (УФ) лучи с высокой энергией, которые могут взаимодействовать с молекулами газов.
В случае метана, фотолиз вызывает разложение молекулы на два радикала метила (CH3•), которые реагируют с кислородом и образуют формальдегид (HCHO) и другие продукты органической химии. При этом происходит потеря углерода и формирование более сложных соединений.
Силан, в свою очередь, разлагается под воздействием УФ-излучения на радикалы кремния, которые реагируют с кислородом и образуют кремний-диоксид (SiO2) и другие кремниевые соединения.
Таким образом, фотолиз играет важную роль в стабильности метана и силана на воздухе. Он обусловливает их разложение и превращение в более сложные соединения под воздействием солнечного излучения.
Анализ частот вибраций межатомных связей

Колебательные движения межатомных связей могут быть описаны как совокупность различных типов колебаний: растяжение, изгиб, кручение и комбинации этих движений. Каждому типу колебания соответствует своя уникальная частота вибрации.
Анализ частот вибраций межатомных связей позволяет определить, насколько жестко связаны атомы в молекуле. Частоты вибраций зависят от силы и длины связи между атомами, поэтому различия в устойчивости соединений могут быть связаны с различиями в этих параметрах.
Например, метан (CH4) и силан (SiH4) имеют схожую структуру, но различаются в устойчивости на воздухе. Анализ частот вибраций межатомных связей в этих молекулах может помочь объяснить это различие.
В метане имеется одна основная колебательная мода - растяжение связи C-H. Частота этой моды составляет около 3000 см-1. Такая высокая частота вибрации указывает на жесткую и крепкую связь между атомами углерода и водорода.
В силане также имеется колебание растяжения связи Si-H, но частота этой моды составляет всего около 2100-2300 см-1. Это свидетельствует о более слабой и менее устойчивой связи между атомами кремния и водорода.
Различия в устойчивости между метаном и силаном на воздухе могут быть объяснены их различными химическими свойствами. Силан имеет более высокую реакционную способность и может быстрее взаимодействовать с кислородом воздуха, что приводит к его более быстрой разложимости по сравнению с метаном.
В итоге, анализ частот вибраций межатомных связей является важным инструментом в исследовании устойчивости химических соединений и помогает понять различия в их поведении на разных условиях.
Сравнение значений для метана и силана
Сравним значения для метана и силана, двух основных органических соединений, которые отличаются своей устойчивостью на воздухе.
- Метан: углеводород, состоящий из одного атома углерода и четырех атомов водорода. Химическая формула: CH4.
- Силан: кремнийорганическое соединение, состоящее из одного атома кремния и четырех атомов водорода. Химическая формула: SiH4.
Основные отличия между этими соединениями можно выделить следующим образом:
- Структура: молекула метана содержит углерод, в то время как молекула силана содержит кремний. Это важное различие, которое определяет их химические свойства и стабильность на воздухе.
- Связи: в метане присутствуют только ковалентные связи C-H, в то время как в силане присутствуют как ковалентные Si-H, так и дополнительные дипольно-дипольные Si-H...H-Si взаимодействия. Эти дополнительные связи делают силан менее устойчивым на воздухе.
- Стабильность: метан химически стабилен на обычных условиях и не вступает в реакции с кислородом воздуха. Однако силан реагирует с кислородом и взрывоопасен при контакте с воздухом. Это объясняется его большей активностью и восприимчивостью к окислительным реакциям.
- Использование: метан широко используется как топливо и сырье для различных процессов, таких как производство электроэнергии и химической промышленности. Силан используется в электронной промышленности для производства полупроводников и других электронных устройств, а также в качестве промежуточного продукта в синтезе органических соединений.
Таким образом, химические свойства метана и силана, а также их реакция с кислородом воздуха определяют их различную устойчивость на воздухе. Это отличие играет важную роль в промышленных процессах и безопасности при их использовании.
Объяснение стабильности метана на воздухе

Основными причинами стабильности метана на воздухе являются:
| 1 | Низкая энергия связи |
| Метан обладает низкой энергией связи между атомами, что делает его малореактивным. Водородные атомы в метане связаны с атомом углерода через ковалентные связи, которые характеризуются низкой энергией. Это делает метан устойчивым и малоактивным на воздухе. | |
| 2 | Отсутствие функциональных групп |
| Метан не содержит функциональных групп, таких как аминогруппы или карбоксильные группы, которые могли бы участвовать в химических реакциях. Это также способствует его стабильности на воздухе. | |
| 3 | Отсутствие двойных или тройных связей |
| Метан состоит только из одиночных ковалентных связей между атомами. Отсутствие двойных или тройных связей делает его менее реактивным на воздухе и способствует его стабильности. |
В целом, все эти факторы вместе обеспечивают метану высокую стабильность на воздухе и делают его одним из наиболее стабильных органических соединений.
Объяснение разложения силана на воздухе

Молекула силана содержит атом кремния (Si), который имеет более низкую электроотрицательность по сравнению с атомом углерода (C), присутствующим в метане. Это означает, что атом кремния в силане обладает большей способностью к донорству электронов, влияющей на химическую активность соединения.
Подверженный донорству электронов, атом кремния образует стабильные ковалентные связи с водородом (H), что делает силан менее реакционноспособным на воздухе по сравнению с метаном. Однако в присутствии влажности молекулы силана начинают вступать в реакцию с водой на поверхности или в атмосфере, что приводит к их разложению.
Разложение силана на воздухе происходит следующим образом: входящие в соединение SiH4 молекулы подвергаются гидролизу - реакции с водой, приводящей к образованию двух молекул водорода (H2) и одной молекулы кремниевого диоксида (SiO2). Данная реакция является экзотермической и может быть самовозглавленной.
Таким образом, хотя силан менее реакционноспособен на воздухе, его разложение идет довольно быстро при воздействии влажности. Понимание механизма разложения силана позволяет контролировать его использование и обеспечивать безопасность в соответствующих процессах и технологиях.



