Галогены - это химическая группа элементов VII группы периодической системы, к которым относятся фтор, хлор, бром, йод и астат. Они являются самыми активными неметаллами в периодической системе и обладают уникальными свойствами, которые определяются их электронной структурой и химическим поведением.
В отличие от многих других элементов, галогены имеют сильно выраженные неметаллические свойства. Они обладают высокой электроотрицательностью, что позволяет им активно взаимодействовать с другими элементами, образуя с ними соли. Галогены хорошо растворяются в воде и образуют кислоты, которые проявляют ярко выраженные кислотные свойства.
Однако галогены также обладают и некоторыми металлическими свойствами. Например, они могут образовывать положительные ионы (катионы) и обладают способностью проводить электрический ток в растворах. Эти металлические свойства галогенов объясняются их половинами заполненных энергетических уровней и наличием лишь одного электрона на внешнем энергетическом уровне.
Металлические свойства галогенов: объяснение и причины

Одно из самых заметных металлических свойств галогенов - это их способность образовывать ионы с отрицательными зарядами и обладать октетным строением. Металлы, как правило, образуют положительно заряженные ионы, поэтому возможность галогенов образовывать отрицательно заряженные ионы делает их уникальными.
Еще одним металлическим свойством галогенов является их способность проводить электричество в растворе или в расплавленном состоянии. Эта свойство обусловлено наличием свободных электронов, которые могут перемещаться и создавать электрический ток.
Эксперименты показали, что галогены могут образовывать соединения с металлами и обладать металлическими свойствами, такими как тяжелая масса, высокая плотность и хорошая термическая и электрическая проводимость. Это свойство объясняется эффектом кристаллической решетки, которая может создавать электронные структуры, сходные с теми, которые присущи металлам.
Однако галогены все равно являются неметаллами, так как их химические свойства связаны с электроотрицательностью и реакционностью. Их металлические свойства обусловлены особыми структурными особенностями и взаимодействиями с другими элементами, что делает их уникальными в мире химии.
Химические свойства металлических галогенов: особенности

Металлические галогены сочетают в себе свойства как металлов, так и галогенов, что придает им некоторые уникальные особенности в химии. В этом разделе рассмотрим основные химические свойства металлических галогенов и их особенности.
Одной из главных особенностей металлических галогенов является их высокая реакционность. Они легко взаимодействуют с другими элементами, образуя разнообразные химические соединения. Это связано с их электроотрицательностью и способностью к передаче электронов.
Металлические галогены образуют ионы, в которых они обладают положительным зарядом. Ионы металлических галогенов имеют меньшую электроотрицательность по сравнению с другими элементами. Это свойство позволяет им проявлять металлические свойства, такие как хорошая электропроводность и термическая проводимость.
Однако, металлические галогены также обладают характерными для галогенов свойствами. Способность галогенов к образованию сильных химических связей проявляется и в их соединениях с металлами. В результате образуются соли металлических галогенов, которые имеют высокую степень ионной связи.
| Свойство | Пример |
|---|---|
| Высокая реакционность | Металлические галогены легко реагируют с другими элементами, например, хлор просто горит при контакте с металлами |
| Электропроводность | Ионы металлических галогенов имеют хорошую электропроводность |
| Образование ионных соединений | Соли металлических галогенов обладают высокой степенью ионной связи |
Таким образом, металлические галогены сочетают в себе свойства металлов и галогенов, что делает их особенными в химии. Их высокая реакционность и способность образовывать ионные соединения делают их важными элементами в различных химических реакциях и процессах.
Неметаллические свойства галогенов: объяснение и причины

Основная причина неметаллических свойств галогенов заключается в том, что у них неполная внешняя оболочка электронов. Все галогены имеют семь электронов во внешней оболочке, а максимальное количество электронов в ней составляет восемь. Это означает, что галогены имеют большую аффинность к электронам и стремятся получить один или несколько электронов для достижения стабильности.
Галогены могут получать электроны через реакцию с другими элементами или соединениями. Они могут образовывать ионы с отрицательным зарядом (анионы), путем присоединения электронов к своей внешней оболочке. Например, водородный ион будет иметь формулу H-, а фторидный ион - F-.
Галогены также образуют соединения с металлами, образуя сильные ионные связи. Ионные соединения галогенов с металлами часто образуют кристаллическую решетку и имеют высокие температуры плавления и кипения. Это объясняется сильными электростатическими притяжениями между положительно и отрицательно заряженными ионами.
Галогены обладают также характерными неметаллическими свойствами, такими как высокая электроотрицательность, высокая реакционная способность, несвойственная металлам, и высокая химическая активность. Они образуют многочисленные соединения со многими элементами и обладают сильными окислительными свойствами.
Неметаллические свойства галогенов играют важную роль в многих химических, физических и биологических процессах. Они находят широкое применение в промышленности, медицине и научных исследованиях. Более того, галогены являются необходимыми элементами для поддержания жизни на Земле и играют важную роль в метаболических процессах организмов.
Химические свойства неметаллических галогенов: особенности

Неметаллические галогены, такие как фтор (F), хлор (Cl), бром (Br) и йод (I), обладают рядом уникальных химических свойств, которые делают их важными в различных областях промышленности и науки.
Электроотрицательность: Неметаллические галогены отличаются высокой электроотрицательностью, что делает их сильными окислителями. Это объясняет их способность к образованию солей и кислотных оксидов.
Восстановительные свойства: Галогены являются сильными окислителями и могут взаимодействовать с другими веществами в окислительно-восстановительных реакциях. Они способны выступать в роли химических агентов во многих процессах.
Реакция с металлами: Галогены проявляют химическую активность в реакциях с металлами. Они могут образовывать соли, такие как хлориды, бромиды и йодиды. Эти соли имеют широкий спектр применений, включая использование в процессе очистки воды и производства фармацевтических препаратов.
Образование кислотных оксидов: Галогены могут образовывать кислотные оксиды при реакции с кислородом или с кислотами. Эти оксиды могут проявлять кислотные свойства и играть важную роль в химических реакциях.
Летучесть: Галогены обладают высокой летучестью, что делает их полезными в различных процессах. Например, хлор используется в процессе очистки питьевой воды, а фтор используется в производстве многочисленных продуктов, таких как пластик и лекарства.
Химическая реактивность: Неметаллические галогены обладают высокой химической реактивностью и могут взаимодействовать с различными веществами. Их способность образовывать стабильные соединения позволяет им выступать в роли важных реагентов в химической индустрии.
В целом, неметаллические галогены имеют уникальные химические свойства, которые делают их важными компонентами в различных химических процессах и промышленностях.
Физические свойства галогенов: рассмотрение
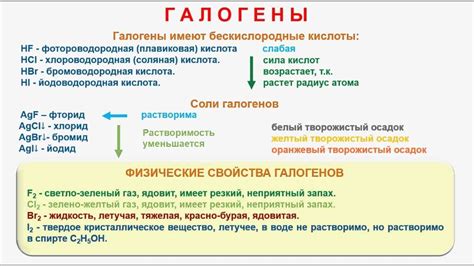
Точка плавления: Галогены обладают низкими точками плавления. Фтор является исключением и имеет самую низкую точку плавления среди галогенов. Точка плавления галогенов увеличивается от фтора к йоду, поскольку атомы становятся все крупнее и сильнее межатомных сил притяжения.
Точка кипения: Галогены обладают низкими точками кипения. Фтор и хлор считаются газами при комнатной температуре, бром – жидкостью, а йод – твердым веществом. Точка кипения галогенов возрастает с увеличением молекулярной массы, поскольку увеличивается число электронов и сила межмолекулярных взаимодействий.
Цвет и запах: Галогены обладают отличительными цветами и запахами. Фтор и хлор – газы без цвета и запаха, бром – красная жидкость с характерным запахом, а йод – фиолетовые кристаллы с запахом.
Положительные окислительные свойства: Галогены проявляют сильные окислительные свойства. Они способны выступать в реакциях с другими элементами, осуществляя окисление, при этом сами восстанавливаются.
Реакция с металлами: Галогены образуют соли с металлами. Например, если хлороводород, содержащий водород и хлор, проходит через раствор металла, то образуется соль металла и выделяется водород.
Реакция с неметаллами: Галогены также образуют соединения с неметаллами. Например, хлор может реагировать с серой, образуя дихлорид серы.
Влияние металлических свойств галогенов на их использование

Проводимость электричества: Некоторые галогены, такие как хлор и бром, могут проявлять металлическое поведение и иметь электропроводность в определенных условиях. Это открывает возможности для использования галогенов в электролитических процессах и производстве электроники.
Термическая и химическая стабильность: Галогены обладают высокой термической и химической стабильностью, что делает их полезными в различных промышленных процессах. Например, фтор используется в производстве полимеров с высокой теплостойкостью, а хлор используется для обеззараживания воды и в производстве пластиков.
Каталитическая активность: Галогены также обладают каталитической активностью и могут использоваться в различных химических реакциях. Например, бром может использоваться как катализатор при производстве фармацевтических препаратов и органических соединений.
Влияние неметаллических свойств галогенов на их использование

Одним из основных неметаллических свойств галогенов является высокая реактивность. Эти элементы имеют сильную способность купаться в электронах, что делает их очень реакционно-способными. Из-за этой характеристики галогены широко используются в химической промышленности для синтеза различных соединений.
Другим важным неметаллическим свойством галогенов является их опасность для жизни. Например, хлор является ядовитым веществом, которое может вызывать серьезные проблемы со здоровьем в случае его неправильного использования. В то же время, галогены также являются полезными источниками для дезинфекции воды и очистки воздуха.
Кроме того, неметаллические свойства галогенов влияют на их физические характеристики, включая высокую плотность и кипящую точку. Благодаря этим свойствам галогены применяются в различных отраслях, таких как производство пластмасс, электроника и фармацевтика.
| Галоген | Неметаллические свойства | Использование |
|---|---|---|
| Фтор (F) | Высокая реактивность, ядовитость | Производство фторированных соединений, дезинфекция воды |
| Хлор (Cl) | Высокая реактивность, ядовитость | Производство пластмасс, дезинфекция воды |
| Бром (Br) | Высокая реактивность | Фотография, производство фармацевтических препаратов |
| Иод (I) | Высокая реактивность | Производство рентгеноконтрастных веществ, лекарственных препаратов |
| Астат (At) | Высокая реактивность | Исследования в области радиоактивности |
Таким образом, неметаллические свойства галогенов играют важную роль в их использовании. Они обеспечивают высокую реактивность и одновременно являются источником проблем для человеческого здоровья. Однако благодаря своим уникальным свойствам, галогены нашли широкое применение в различных сферах науки и промышленности.



