Атомы - основные строительные блоки вещества. Внутри них находятся электроны, нейтроны и протоны. Но как распределены электроны в атоме? Какие правила определяют количество электронов в каждом подуровне? В этой статье мы рассмотрим все детали.
Атомы состоят из энергетических уровней, которые в свою очередь разделены на подуровни. Количество электронов в каждом подуровне зависит от его энергии и формулы, известной как правило Клечковского. Согласно этому правилу, каждый подуровень может содержать ограниченное количество электронов.
Правило Клечковского:
1. s-подуровень может содержать не более 2 электронов.
2. p-подуровень может содержать не более 6 электронов.
3. d-подуровень может содержать не более 10 электронов.
4. f-подуровень может содержать не более 14 электронов.
Теперь давайте рассмотрим несколько примеров. Разберемся, сколько электронов содержатся в различных подуровнях:
Пример 1: s-подуровень
Для элемента второго периода, такого как литий (Li), s-подуровень содержит 2 электрона. Атом лития имеет электронную конфигурацию 1s^2, где 1s - обозначает s-подуровень и ^2 - обозначает 2 электрона.
Пример 2: p-подуровень
Для элемента третьего периода, такого как алюминий (Al), p-подуровень содержит 6 электронов. Атом алюминия имеет электронную конфигурацию 1s^2 2s^2 2p^6 3s^2 3p^1, где 2p - обозначает p-подуровень и ^6 - обозначает 6 электронов.
Пример 3: d-подуровень
Для элемента четвертого периода, такого как железо (Fe), d-подуровень содержит 10 электронов. Атом железа имеет электронную конфигурацию 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^6, где 3d - обозначает d-подуровень и ^6 - обозначает 6 электронов.
Таким образом, количество электронов в каждом подуровне зависит от его типа и может быть определено с помощью правила Клечковского. Понимание этого правила позволяет увидеть закономерности распределения электронов в атомах и получить представление о их строении и свойствах.
Подуровни в атомах и количество электронов
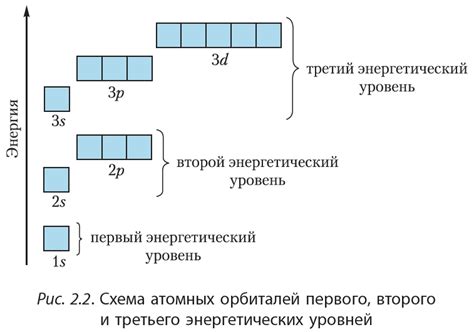
Существует четыре основных подуровня - s, p, d и f. Подуровень s имеет форму сферы и может содержать до 2 электронов. Подуровень p имеет форму шарового пучка и может содержать до 6 электронов. Подуровень d имеет форму двусвязанного колечка и может содержать до 10 электронов. Подуровень f имеет более сложную форму и может также содержать до 14 электронов.
Количество подуровней в атоме зависит от номера энергетического уровня. Первый энергетический уровень содержит только подуровень s, второй - подуровни s и p, третий - подуровни s, p и d, а четвертый и последующие - все четыре основных подуровня.
Например, в атоме кислорода (O) на втором энергетическом уровне есть подуровень s и подуровень p. Подуровень s может содержать до 2 электронов, а подуровень p - до 6 электронов. Таким образом, в атоме кислорода на втором энергетическом уровне может находиться до 8 электронов.
Знание количества электронов в каждом подуровне атома позволяет строить электронную конфигурацию и предсказывать химические свойства элементов.
S-подуровень: 2 электрона

S-подуровень представляет собой основной энергетический уровень в атоме. В нем могут находиться максимум 2 электрона.
На S-подуровне имеется всего один подуровень - s-подподуровень, обозначаемый буквой s. В s-подподуровне может разместиться всего 1 электрон, а значит в S-подуровне может быть только 2 электрона.
Примером элемента, у которого S-подуровень полностью заполнен, является гелий (He) с атомным номером 2. У гелия на S-подуровне находится 2 электрона, заполняющих s-подподуровень.
P-подуровень: 6 электронов
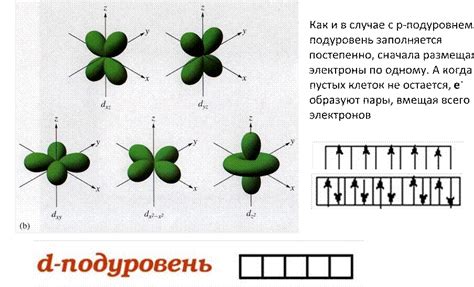
В p-подуровне может находиться до 6 электронов. Этот подуровень состоит из 3 подуровней p_x, p_y и p_z, каждый из которых может содержать по 2 электрона. Таким образом, в п-подуровне общее количество электронов составляет 6.
| Подуровень | p_x | p_y | p_z |
|---|---|---|---|
| Максимальное количество электронов | 2 | 2 | 2 |
Примеры элементов, у которых p-подуровень заполнен 6 электронами: кислород (О), сера (S), селен (Se) и флеровий (Fl).
D-подуровень: 10 электронов
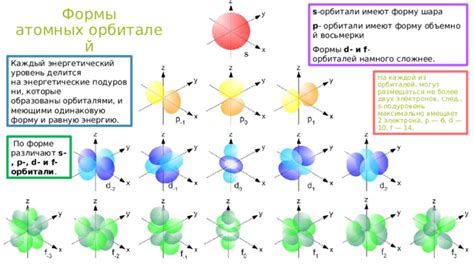
D-подуровень состоит из пяти подоболочек, обозначаемых как d1, d2, d3, d4 и d5. Каждая из этих подоболочек может содержать по два электрона:
- d1: 2 электрона
- d2: 2 электрона
- d3: 2 электрона
- d4: 2 электрона
- d5: 2 электрона
Таким образом, суммарное количество электронов в d-подуровне составляет 10.
Примеры элементов, в которых d-подуровень содержит 10 электронов:
- Титан (Ti): 1s2 2s2 2p6 3s2 3p6 4s2 3d2
- Хром (Cr): 1s2 2s2 2p6 3s2 3p6 4s1 3d5
- Медь (Cu): 1s2 2s2 2p6 3s2 3p6 4s1 3d10
Д-подуровень и количество электронов в нем играют важную роль в химических свойствах различных элементов и определяют их способность образовывать соединения и сочетания с другими элементами.
F-подуровень: 14 электронов
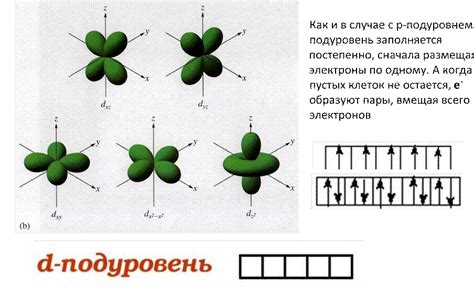
Как и у других подуровней, электроны в F-подуровне заполняются в порядке возрастания их энергии. Первыми заполняются орбитали с наиболее низкой энергией. Таким образом, в F-подуровне первые два электрона заполняют первую орбиталь, следующие два электрона - вторую орбиталь, и так далее, пока не будут заполнены все семь орбиталей.
S-подуровень является самым энергетически низким в F-подуровне. Он включает три орбитали, каждая из которых способна вместить по два электрона. P-подуровень состоит из трех орбиталей и тоже вмещает по два электрона. D-подуровень состоит из пяти орбиталей, каждая способна вместить по два электрона. И, наконец, F-подуровень содержит семь орбиталей, каждая из которых также может вместить по два электрона.
Пример атома, в котором F-подуровень содержит 14 электронов, - атом хлора. Хлор имеет атомный номер 17, что означает, что у него насчитывается 17 электронов. Таким образом, первые два электрона заполняют орбитали s-подуровня, следующие шесть электронов - орбитали p-подуровня, и оставшиеся шесть электронов заполняют орбитали d-подуровня. Все эти электроны находятся в F-подуровне и направлены на 14 орбиталей этого подуровня.
Примеры в S-подуровне: гелий (He), литий (Li)

Гелий (He) - это элемент с атомным номером 2 и электронной конфигурацией 1s2. То есть у гелия два электрона, которые занимают оба подуровня S-подуровня.
Литий (Li) - это элемент с атомным номером 3 и электронной конфигурацией 1s2 2s1. У лития также два электрона в 1s-подуровне и один электрон в 2s-подуровне.
Примеры в P-подуровне: фосфор (P), серебро (Ag)
В P-подуровне находятся атомы с атомным номером 15. В основном состоянии, один атом фосфора имеет электронную конфигурацию [Ne] 3s2 3p3. Это означает, что на P-подуровне есть 5 электронов, распределенных следующим образом: 2 электрона в 3s-субуровне и 3 электрона в 3p-субуровне.
Серебро (Ag) имеет атомный номер 47 и имеет электронную конфигурацию [Kr] 5s2 4d9. На P-подуровне находятся только 1 электрон, которое находится в 5s-субуровне. В 5p-подуровне у серебра нет электронов.
Примеры в D-подуровне: железо (Fe), марганец (Mn)
В D-подуровне находятся элементы с атомами, у которых электроны размещаются в 5 подуровнях (5s, 4d, 5p, 6s, 4f) с четырьмя электронами в подуровне 4d.
Железо (Fe) - переходный металл, находится в 8 группе периодической системы. У его атома 26 электронов, из которых два находятся в подуровне 5s, четыре - в подуровне 4d, и оставшиеся двадцать - в пятом подуровне 3p.
Марганец (Mn) также является переходным металлом и находится в 7 группе. У атома марганца 25 электронов, распределенных следующим образом: два электрона в подуровне 5s, пять - в подуровне 4d и остаток - в третьем подуровне 3p.
Примеры в F-подуровне: астронций (As), радий (Ra)

В F-подуровне электронная конфигурация может иметь варианты от 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d10 6p6 7s2 5f0 до 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d10 6p6 7s2 5f14. Например, астронций (As) имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d10 6s2 6p6 7s2.
Астронций (As) является металлом переходной группы, который находится в 6-й группе периодической таблицы. Он имеет атомный номер 33, что означает, что у него 33 электрона. В F-подуровне астронция имеет максимальное количество электронов - 14. Таким образом, электронная конфигурация астронция состоит из всех возможных электронов в f-подуровне.
Радий (Ra) также находится в F-подуровне и имеет максимальное количество электронов - 14. Электронная конфигурация радия состоит из 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d10 6s2 6p6 7s2.
Радий (Ra) - это металл щелочноземельной группы, который находится в 7-й группе периодической таблицы. Радий имеет атомный номер 88, поэтому у него 88 электронов. В F-подуровне радия находится максимальное количество электронов - 14. Таким образом, электронная конфигурация радия состоит из всех возможных электронов в f-подуровне.
Общие правила количества электронов в подуровнях

В атоме электроны располагаются в электронных оболочках и подуровнях. Каждый подуровень может содержать определенное количество электронов.
Для определения количества электронов в каждом подуровне существуют следующие правила:
- Подуровень s может содержать максимум 2 электрона.
- Подуровень p может содержать максимум 6 электронов.
- Подуровень d может содержать максимум 10 электронов.
- Подуровень f может содержать максимум 14 электронов.
Например, подуровень s будет заполнен сначала до 2 электронов, затем p будет заполняться сначала до 6 электронов, а дальше – подуровень d будет заполняться до 10 электронов и так далее.
Понимание этих правил очень важно при изучении атомной структуры и химических связей, так как количество электронов в каждом подуровне определяет вещественные свойства элементов.



