Молекула воды, будучи одной из наиболее известных и изученных молекул, оказывается удивительной по своим свойствам и структуре. Она состоит из трех атомов - двух атомов водорода (H) и одного атома кислорода (O), связанных ковалентными связями. Эти связи между атомами создают электронные пары, которые определяют химические и физические свойства воды.
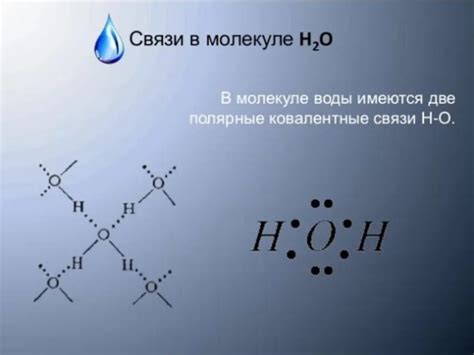
В молекуле воды имеется две электронные пары, которые находятся вокруг центрального атома кислорода. Эти электронные пары представляют собой области пространства, где находятся электроны и создают электронную область вокруг атомов. Они создают индивидуальные области отталкивания, что придает молекуле воды уникальную структуру и форму.
Электронные пары в молекуле воды играют важную роль во многих химических реакциях и свойствах. Например, они определяют электронную геометрию молекулы, которая влияет на ее полярность. Полярность молекулы делает воду полем диполя, что приводит к многим физическим и химическим свойствам, таким как высокая теплопроводность, высокая теплоемкость и способность к образованию водородных связей.
Молекула воды: основные характеристики

Молекула воды (H2O) состоит из двух атомов водорода и одного атома кислорода, соединенных ковалентными связями.
Молекула воды является уникальной и важной для жизни на Земле.
Одна из главных характеристик молекулы воды - ее полярность. Из-за разницы в электроотрицательности атомов водорода и кислорода, электронные облака в молекуле воды перераспределяются таким образом, что образуются положительно заряженный конец (водородные атомы) и отрицательно заряженный конец (кислородный атом).
Эта полярность позволяет молекулам воды образовывать водородные связи между собой и с другими молекулами. Водородные связи обладают высокой прочностью и определяют многие свойства воды, такие как ее высокая теплопроводность и поверхностное натяжение.
Молекула воды также является полидиэром. Она может образовывать внутренний водородный связи между прилегающими молекулами, создавая структуры в виде кластеров.
Электронные пары в молекуле воды распределяются таким образом, что кислородный атом обладает двумя непарными электронными парами, а каждый водородный атом обладает одной непарной электронной парой. Это делает молекулу воды устойчивой и придает ей уникальный угловой вид, известный как «угол воды», равный примерно 104,5 градусам.
Молекула воды обладает высоким диэлектрическим постоянным, что делает ее хорошим растворителем для многих веществ. Благодаря этому свойству вода является универсальным средством для различных химических реакций и биологических процессов.
Структура молекулы воды
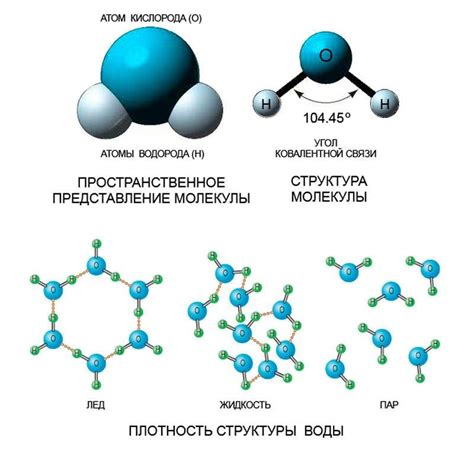
Молекула воды (H2O) представляет собой трехатомный составной молекулы, состоящий из двух атомов водорода (H) и одного атома кислорода (O). Эта молекула обладает уникальной структурой и свойствами, которые обусловлены ее формой и режимом связей между атомами.
Основная характеристика структуры молекулы воды - угловая. Атомы водорода связаны с атомом кислорода через электронные пары, формируя две химические связи. Угол между этими связями составляет примерно 104,5 градусов. Это связано с тем, что электронные облака водородных атомов отталкиваются друг от друга, достигая более устойчивого положения при указанном угле.
Каждый атом водорода в молекуле воды образует со своим атомом кислорода ковалентную связь, состоящую из одной общей пары электронов. Таким образом, молекула воды имеет две электронные пары.
Свойства молекулы воды напрямую зависят от ее структуры. Благодаря загрязненным электронным связям между атомами, молекула воды обладает полярностью. Это делает воду поларное растворительное средство, способное растворить множество веществ и участвовать во многих химических реакциях.
Благодаря своей уникальной структуре молекулы воды обладают такими важными свойствами, как высокая теплоемкость, теплота парообразования, поверхностное натяжение и капиллярное действие. Все это делает воду основным элементом жизни и необходимым для поддержания жизнедеятельности многих организмов на Земле.
Свойства молекулы воды
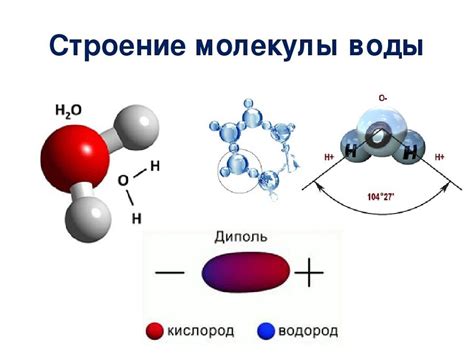
Молекула воды (H2O) имеет уникальные свойства, которые определяют ее широкую распространенность в природе и важность для жизни на Земле.
1. Полярность: Молекула воды имеет полярную структуру, что означает, что она имеет неполярные ковалентные связи, но имеет распределение электронной плотности, которое несимметрично относительно атомов водорода и кислорода. Это свойство позволяет молекуле воды образовывать водородные связи и обуславливает множество ее физических и химических свойств.
2. Высокая тепловая емкость: Водяные молекулы обладают высокой тепловой емкостью, что означает, что им требуется больше энергии для повышения температуры. Это свойство играет важную роль в регулировании температуры окружающей среды, позволяя водным резервуарам и океанам мягко реагировать на изменения погодных условий.
3. Свойства растворителя: Молекулы воды способны образовывать водородные связи с другими поларными и некоторыми ионными соединениями. Благодаря этому, вода является отличным растворителем для множества веществ, включая соли, сахара и кислородные газы.
4. Высокая поверхностная натяжение: Водяные молекулы образуют водородные связи не только в объеме, но и на поверхности жидкости. Это приводит к образованию пленки, известной как поверхностное натяжение. Это свойство позволяет некоторым живым организмам, таким как насекомые, ходить по водной поверхности.
5. Высокая плотность в жидком состоянии: Молекулы воды располагаются ближе друг к другу в жидком состоянии по сравнению с газообразным, что обеспечивает высокую плотность воды в этом состоянии. Это вызывает явление, известное как аномальное расширение воды при замерзании, когда молекулы воды образуют структурный кристалл льда и занимают больше места, что делает лед менее плотным, чем вода, что позволяет сохранять жизненно важные организмы под замерзшей поверхностью.
Молекула воды обладает множеством других уникальных свойств, которые делают ее особенно важной для жизни на Земле. Ее способность образовывать водородные связи, наличие полярной структуры и высокая плотность в жидком состоянии сделали воду необходимой и незаменимой для существования различных экосистем и живых организмов.
Электроны в молекуле воды
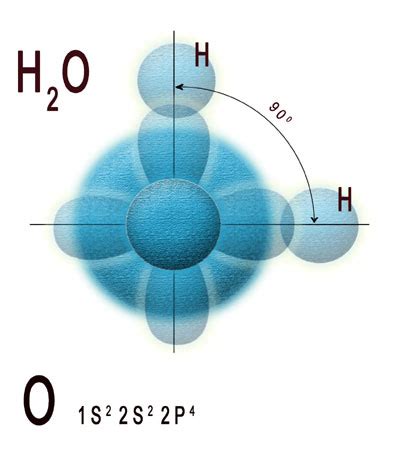
Молекула воды, химическая формула которой H2O, состоит из двух атомов водорода и одного атома кислорода, связанных ковалентной связью. Общая структура молекулы воды имеет форму угла, известного как угол воды, который составляет около 104,5 градусов.
В молекуле воды электроны распределяются по орбиталям атомов водорода и кислорода. Кислород обладает большей электроотрицательностью, что делает его электронную оболочку частично отрицательно заряженной. Когда атом водорода приближается к атому кислорода, образуется дипольное взаимодействие, в котором электроны притягиваются к кислороду, создавая электронное облако близко к нему.
Таким образом, в молекуле воды имеется два электронных пары, которые отталкиваются друг от друга и держат водородные атомы на определенном расстоянии друг от друга. Это облегчает образование водородных связей между молекулами воды и придает ей уникальные химические и физические свойства.
Также стоит отметить, что электронные пары в молекуле воды играют важную роль в ее реакционной способности и взаимодействии с другими веществами. Обмен электронами между молекулами воды и другими веществами может приводить к образованию новых химических соединений и реакциям, таким как гидролиз или окисление.
Сколько электронных пар в молекуле воды

Каждый атом кислорода образует две связи с двумя атомами водорода, используя по одной электронной паре для каждой связи. Таким образом, в молекуле воды имеется две электронные пары, связывающие каждый атом кислорода с атомами водорода.
Электронные пары воды обеспечивают ей форму угла, известного как угол примыкания, между двумя связями. Этот угол составляет примерно 104,5 градуса и обуславливает специфические физические и химические свойства воды.
Роль электронов в молекуле воды

Молекула воды (H2O) состоит из двух атомов водорода и одного атома кислорода. Всего в молекуле воды находится 10 электронных пар. Как вода становится жидкостью при комнатной температуре, а затем превращается в пар при нагревании? Ответ на эти вопросы может быть найден в роли электронов.
Каждый атом водорода в молекуле воды имеет один электрон. Эти два электрона образуют так называемую ковалентную связь с атомом кислорода, который имеет шесть электронов. Таким образом, в молекуле воды образуется две ковалентные связи. Электроны в этих связях создают силы притяжения и держат атомы водорода и кислорода вместе, образуя стабильную молекулу воды.
Оставшиеся два электрона на атоме кислорода образуют электронные пары. Эти электронные пары создают области, где кислородный атом имеет высокую электронную плотность. Это приводит к образованию полярной молекулы воды, где кислородный атом частично отрицателен, а атомы водорода частично положительны.
Полярность молекулы воды играет важную роль во многих ее свойствах. Например, она делает молекулу воды поларной растворителем, что обуславливает ее способность растворять множество веществ. Кроме того, полярные молекулы воды обладают сильными межмолекулярными силами, называемыми водородными связями, которые существенно влияют на ее свойства, такие как поверхностное натяжение и теплоемкость.
Таким образом, электроны в молекуле воды играют центральную роль в ее структуре и свойствах. Связи, образованные электронами, ковалентные связи и водородные связи, обеспечивают стабильность и взаимодействие между молекулами воды, что делает ее основным компонентом жизни на Земле.
Влияние электронных пар на свойства воды
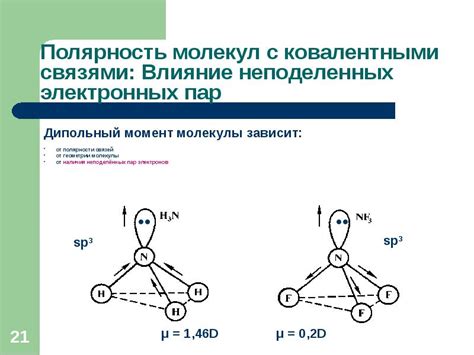
Молекула воды состоит из одного атома кислорода и двух атомов водорода, связанных между собой. Эти связи образуются благодаря электронным парам в атомах. Электронные пары, находящиеся в молекуле воды, оказывают значительное влияние на ее свойства и связаны с рядом интересных явлений и химических реакций.
Наличие электронных пар в молекуле воды обуславливает ее поларность. Кислородный атом, как атом с более высокой электроотрицательностью, притягивает электроны сильнее, чем водородные атомы. Это создает неравномерное распределение электронной плотности в молекуле, делая ее полярной. Благодаря этой поларности, молекулы воды образуют водородные связи, которые обеспечивают уникальные свойства вещества.
Электронные пары также играют решающую роль в фазовых переходах воды. При нагревании электроны воды приходят в состояние с более высокой энергией, что приводит к изменению их расположения. Молекулы воды, у которых были электронные пары, теряют эти пары и переходят из жидкой фазы в газообразную. Таким образом, электронные пары определяют точку кипения воды и обусловливают ее возможность перехода из одной фазы в другую.
Кроме того, электронные пары в молекуле воды также связаны с ее способностью растворять множество веществ. Растворимость веществ в воде обусловлена способностью молекулы воды образовывать водородные связи с другими молекулами. Электронные пары позволяют водным молекулам притягивать и удерживать другие молекулы, что способствует их растворению и образованию раствора.
Таким образом, электронные пары в молекуле воды играют ключевую роль в ее свойствах и химических реакциях. Они определяют поларность, возможность фазовых переходов и способность растворять другие вещества. Понимание роли электронных пар в воде является важным для понимания ее физических и химических свойств и применений этого непомерно важного вещества в нашей повседневной жизни.
Использование молекулы воды в научных и промышленных целях
В научных исследованиях молекула воды играет важную роль. Ее уникальные свойства, такие как высокая теплоемкость и теплопроводность, делают ее незаменимой для изучения термодинамики и физических процессов. Кроме того, вода является отличным растворителем для многих веществ, что позволяет исследователям изучать химические реакции и взаимодействия различных веществ.
Молекула воды также широко используется в промышленности. Например, вода служит основным компонентом в процессах охлаждения в различных технологических процессах, таких как в производстве электроэнергии и в металлургии. Кроме того, вода используется в качестве растворителя при производстве многих химических веществ, пищевых продуктов и лекарственных препаратов.
Важно отметить, что молекула воды обладает особой структурой, в которой электроны распределены между атомами водорода и кислорода. Это обусловливает высокую полярность молекулы и возможность образования водородных связей, что в свою очередь делает молекулу воды устойчивой и позволяет ей выполнять свои функции в науке и промышленности.
В целом, использование молекулы воды в научных и промышленных целях играет важную роль в разнообразных отраслях и способствует развитию науки и технологий.
Значение молекулы воды в живых организмах

Молекула воды (H2O) играет важную роль в живых организмах. Ее уникальная структура и свойства делают ее неотъемлемой частью многих биологических процессов.
Вода играет ключевую роль в поддержании гомеостаза в организмах. Она используется в процессах пищеварения, транспортировки питательных веществ и удаления отходов. Кроме того, вода является универсальным растворителем, что позволяет ей участвовать в метаболических реакциях и регулировании температуры организма.
Молекула воды также играет ключевую роль в обеспечении структурной целостности клеток и тканей. Она обладает сильными водородными связями, которые создают стабильные трехмерные структуры, такие как клеточные мембраны и ДНК. Благодаря этим связям вода способна поддерживать форму и функцию живых организмов.
Кроме того, вода участвует в регуляции температуры живых организмов. Благодаря высокой теплоемкости и теплопроводности, вода способна поглощать и отдавать большое количество тепла без существенного изменения своей температуры. Это позволяет ей регулировать температурные условия внутри организма, предотвращая перегрев или переохлаждение.
Кроме того, вода участвует в химических реакциях, таких как гидролиз и дегидратация, играя роль как реагент или продукт. Она также служит важным ионом во многих биологических процессах, таких как передача нервных импульсов и сокращение мышц.
Таким образом, молекула воды имеет огромное значение для живых организмов. Ее структура и свойства позволяют ей участвовать во множестве биологических процессов, обеспечивая жизнедеятельность организмов.



