Белки – это важные молекулы, которые выполняют множество функций в нашем организме. Они являются основным строительным материалом всех клеток и участвуют в множестве биохимических процессов. Однако не все белки равны, и у них может быть разная структура, в том числе и разная прочность.
Среди разных структур белка самой прочной является третичная структура. Третичная структура – это сложное пространственное складывание белковой цепи, обусловленное взаимодействием различных аминокислотных остатков между собой. Она определяет форму и функцию белка. Однако, для достижения максимального уровня прочности, требуется также наличие других структурных элементов – вторичной и примарной структур.
Вторичная структура определяется упорядоченными пространственными расположениями аминокислотных остатков внутри молекулы белка. Вторичная структура может иметь различные формы, такие как а-спираль (преобладание правосторонней витрины) и плоскость (аминокислоты, расположенные бок о бок). Плоскость – это самый прочный элемент вторичной структуры, так как аминокислоты, находящиеся рядом, тесно связаны друг с другом, образуя стабильные взаимодействия.
Биологический исходный материал

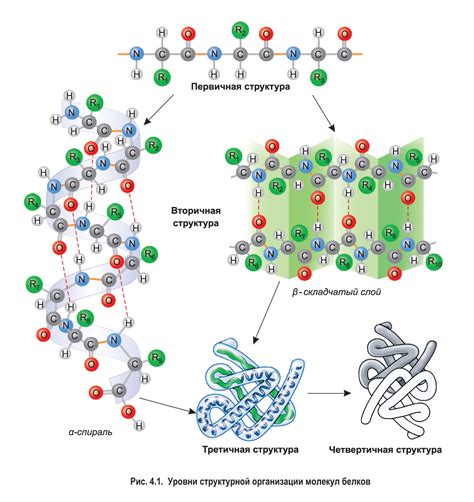
Структура белка включает в себя четыре уровня организации: первичную, вторичную, третичную и кватернарную структуру. Первичная структура определяется последовательностью аминокислот в цепочке белка. Вторичная структура образуется благодаря образованию спиралей альфа и бета-складок. Третичная структура определяет пространственное расположение различных участков белка. Кватернарная структура состоит из нескольких подцепей белка, которые соединяются вместе и образуют функциональный комплекс.
Прочность белка зависит от его структуры. Некоторые белки обладают высокой прочностью благодаря своей вторичной и третичной структуре. Например, коллаген, который является основным структурным компонентом соединительной ткани, обладает высокой прочностью благодаря своей спиральной структуре. Также, кератин, который образует волосы и ногти, обладает высокой прочностью благодаря своей вторичной и третичной структуре.
Однако, каждый белок имеет свою уникальную структуру и функцию, поэтому прочность белка зависит от его конкретной структуры и взаимодействия с другими молекулами в организме. Некоторые белки могут быть более прочными в определенных условиях или при взаимодействии с другими молекулами.
| Название | Описание |
|---|---|
| Коллаген | Основной структурный компонент соединительной ткани, обладает высокой прочностью |
| Кератин | Образует волосы и ногти, обладает высокой прочностью |
| Миозин | Участвует в сокращении мышц, обладает высокой прочностью и гибкостью |
Особенности молекулярной структуры
Молекулярная структура белка представляет собой сложную трехмерную конформацию, которая обеспечивает его функциональность и прочность. Однако, не все структуры белков одинаково прочные.
Существует несколько типов молекулярной структуры белка, но наиболее прочными считаются витки альфа-спирали и бета-складки.
Альфа-спираль - это устойчивая структура, образующаяся благодаря взаимодействию водородных связей между аминокислотными остатками. Витки альфа-спирали обладают высокой энергетической стабильностью и способны выдерживать большие механические нагрузки.
Бета-складки - это другой тип структуры белка, представляющий собой разделение цепи аминокислот на листовидные структуры, связанные водородными связями. Благодаря своей трехмерной конформации, бета-складки также обладают высокой прочностью.
Прочность молекулярной структуры белков обусловлена не только типом структуры, но и последовательностью аминокислотных остатков. Даже небольшие изменения в последовательности могут существенно повлиять на прочность белка.
В целом, молекулярная структура белка должна быть тесно связана с его функциональностью и способностью выдерживать внешние воздействия.
Ковалентные связи в структуре белка
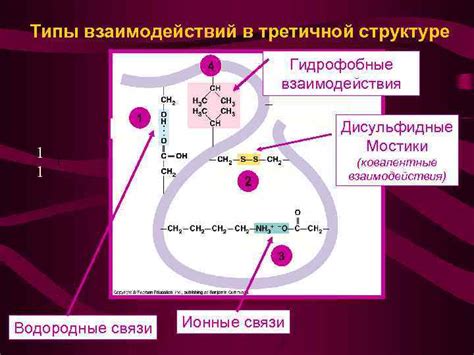
Ковалентные связи образуются путем обмена электронами между атомами, что приводит к образованию пары связанных атомов. В структуре белка, ковалентные связи образуются между аминокислотными остатками, которые содержат функциональные группы, такие как карбоксильная группа (COOH) и аминогруппа (NH2).
Ковалентные связи в структуре белка обладают высокой прочностью и устойчивостью. Они обеспечивают стабильность пространственной конформации белка и играют важную роль в его функции.
Ковалентные связи также могут образоваться между аминокислотными остатками и другими молекулами, такими как кофакторы или субстраты. Эти связи могут играть ключевую роль в специфической взаимодействии белка с другими молекулами и определять его функцию.
Ковалентные связи в структуре белка обладают высокой надежностью и обеспечивают прочность и устойчивость белковых структур. Их формирование и разрушение могут быть контролируемыми процессами, что позволяет белкам гибко адаптироваться к изменяющимся условиям и выполнять свои функции.
Слабые взаимодействия

Водородные связи - это слабые электростатические взаимодействия между водородной группой и электронной парой на атоме соседней молекулы или группы внутри молекулы. Эти связи позволяют создавать стабильные пространственные структуры белка.
Ионные связи образуются между атомами с противоположными зарядами. Они способствуют установлению некоторых топологических свойств белка, таких как формирование спиралей и листов.
Ван-дер-ваальсовы взаимодействия основаны на дипольных притяжениях и индуцированных дипольных моментах между нейтральными атомами или молекулами. Эти взаимодействия помогают сформировать пространственную структуру белка и поддерживают его стабильность.
Гидрофобные взаимодействия возникают между неполярными группами аминокислот и вызваны стремлением гидрофобных остатков уходить от воды и образовывать гидрофобные карманы внутри белка. Эти взаимодействия также способствуют формированию и поддержанию трехмерной структуры белка.
Роль водородной связи в прочности белков
Водородная связь представляет собой слабую химическую связь между атомами водорода, а также атомами кислорода, азота и серы. Такая связь образуется благодаря разделению электронной плотности между двумя электронегативными атомами. Это позволяет создавать стабильную трехмерную структуру белков.
Водородные связи отвечают за формирование вторичной структуры белка, такой как α-спираль и β-складки. Они могут также быть причиной образования третичной и кватернарной структуры белка. Эти взаимодействия между атомами обеспечивают стабильность структуры и позволяют белкам выполнять свои функции.
Важно отметить, что водородные связи являются слабыми по сравнению с ковалентными связями, но их роль в структуре белка не менее важна. Их слабость обеспечивает гибкость белковых молекул, что позволяет им легко изменять свою конформацию, что в свою очередь является необходимым для выполнения различных функций белковых молекул.
Таким образом, водородные связи играют важную роль в стабильности и прочности белков. Они образуют структуру белка и позволяют ему выполнять свои функции. Понимание роли водородной связи в прочности белков важно для разработки новых методов модификации и улучшения структуры белковых молекул для различных биотехнологических и медицинских приложений.
Влияние структуры белка на его прочность
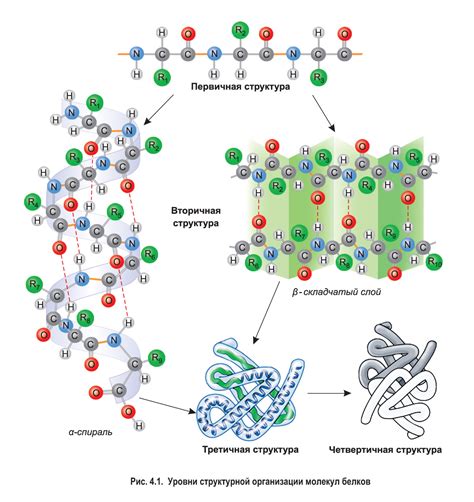
Структура белка играет важную роль в его прочности и устойчивости к внешним воздействиям. Белки состоят из аминокислот, которые связываются между собой и образуют различные структуры, определяющие их функциональные свойства.
Наиболее прочной структурой белка является его третичная структура. В третичной структуре белок принимает определенную пространственную конфигурацию, образуя свернутую спираль или сложную трехмерную форму. Это достигается благодаря взаимодействию аминокислотных остатков внутри белковой цепи.
Влияние третичной структуры на прочность белка объясняется тем, что она определяет его устойчивость к различным воздействиям, включая изменения pH, температуры, давления и наличие различных химических веществ. Белки с более сложной трехмерной структурой обычно обладают высокой прочностью и стабильностью.
Однако, помимо третичной структуры, и другие уровни структуры белка, такие как первичная, вторичная и кватерническая, могут влиять на его прочность. Первичная структура определяется последовательностью аминокислот в белковой цепи и может влиять на образование вторичных и третичных структур. Вторичная структура определяется взаимодействием аминокислотных остатков и может быть представлена в виде спиральной α-гелици либо сбалансированными β-складками.
Кватерническая структура, представляющая собой взаимодействие нескольких белковых подединиц, также может влиять на прочность белка. Взаимодействие между различными подединицами может усиливать структуру и устойчивость белка.
Таким образом, структура белка оказывает значительное влияние на его прочность. Наиболее прочной является третичная структура, но все уровни структуры белка играют свою роль в его устойчивости и функционировании.



