Кипение - это явление, которое мы наблюдаем, когда вода или другая жидкость начинают закипать при нагревании. Но почему это происходит и почему вода начинает кипеть при определенной температуре? Ответ на эти вопросы интересен и понятен для 8 класса.
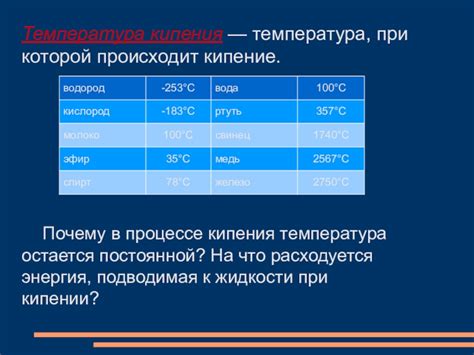
Само кипение - это процесс перехода жидкости в газообразное состояние. Это происходит при достижении определенной температуры, которая называется температурой кипения. Для воды эта температура равна 100 градусам Цельсия. Когда вода начинает нагреваться, ее молекулы начинают двигаться быстрее и они начинают отделяться от жидкости в виде пара. Наличие между молекулами воды притягательных сил затрудняет их движение, но при нагревании этот эффект ослабевает.
На самом деле, температура кипения жидкости зависит от давления, который находится над жидкостью. В обычных условиях (на уровне моря), вода кипит при 100 градусах Цельсия. Но если мы находимся на большой высоте, где давление воздуха ниже, то температура кипения воды также будет ниже. Это объясняет, почему горное озеро может закипеть при низкой температуре.
Важно помнить, что кипение не является последствием очень высокой температуры, а, на самом деле, происходит при постоянной температуре, когда давление достигает необходимого значения. Мы видим пузырьки, всплывающие на поверхности жидкости, что указывает на кипение.
Кипение: что это такое?

Точка кипения зависит от давления. Под нормальным атмосферным давлением точка кипения воды равна 100 градусам Цельсия. Однако, при изменении давления точка кипения может быть и выше, и ниже. Например, при увеличении давления точка кипения воды повышается, а при снижении давления она становится ниже. Именно поэтому в некоторых регионах, расположенных на больших высотах над уровнем моря, вода кипит при более низкой температуре.
Кипение – это фазовый переход, который протекает при постоянной температуре. В процессе кипения происходит интенсивное испарение жидкости и образование водяных паров. В то время как на поверхности жидкости пары образуются и исчезают, внутри жидкости между молекулами происходят сложные перемещения. По мере повышения температуры ускоряется движение молекул и кипение становится все более интенсивным.
| Причины кипения: | Эффекты кипения: |
|---|---|
| Повышение температуры | Выделение теплоты |
| Снижение давления | Охлаждение жидкости |
| Добавление инородного вещества (например, соль) | Образование пузырьков пара |
Кипение широко используется в быту и промышленности. Например, для приготовления пищи, стирки белья и производства пара для привода турбин и двигателей. Также, кипение является важным процессом при проведении химических реакций и приготовлении лекарств.
Почему кипение происходит при постоянной температуре?
Ответ на этот вопрос связан с межмолекулярными силами вещества. Внутри жидкости молекулы совершают постоянное движение и сталкиваются друг с другом. При достаточно низкой температуре эти столкновения недостаточно энергичные, чтобы преодолеть межмолекулярные силы притяжения и жидкость остается в жидком состоянии.
Однако с увеличением температуры кинетическая энергия молекул увеличивается, и они начинают сталкиваться с большей силой. При достижении определенной температуры, называемой температурой кипения, энергия столкновений достаточна для преодоления межмолекулярных сил и жидкость начинает превращаться в пар.
Кипение происходит при постоянной температуре потому, что при нагревании молекулы жидкости получают энергию, но эта энергия уходит не на повышение температуры, а на преодоление межмолекулярных сил. Поэтому температура жидкости остается постоянной до тех пор, пока все жидкость не превратится в пар.
Таким образом, кипение происходит при постоянной температуре из-за баланса межмолекулярных сил притяжения и кинетической энергии молекул. У каждого вещества есть своя уникальная температура кипения, которая зависит от его химической структуры и межмолекулярных взаимодействий.
Молекулярные связи и кипение
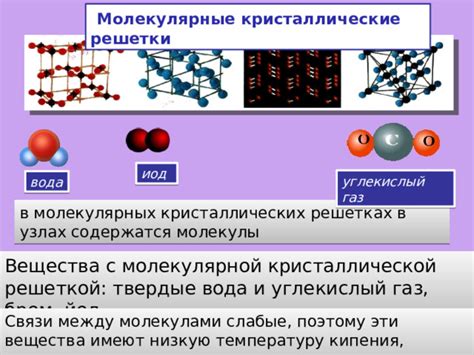
Когда вещество нагревается, его молекулы начинают двигаться все быстрее. Виды движений молекул зависят от силы молекулярных связей, которые их удерживают вместе.
Если молекулы вещества образуют слабые связи, например, водородные связи или ван-дер-ваальсовы силы, то при нагревании эти связи легко разрушаются. Молекулы быстро отдаляются друг от друга, образуя газообразное состояние. Этот процесс называется кипением.
Кипение происходит только при определенной температуре, называемой температурой кипения. При достижении этой температуры, вещество начинает находиться в состоянии кипения, и его молекулы активно испаряются, образуя пары газа.
Если молекулы вещества образуют крепкие связи, например, ионные или ковалентные связи, то при нагревании эти связи сложно разрушить. Молекулы остаются близкими друг к другу, и самое высокое состояние движения, которое они могут достичь, называется состоянием жидкости. Вещество при этом не кипит, а просто нагревается до определенной температуры.
Таким образом, кипение происходит при постоянной температуре, потому что в этот момент молекулярные связи становятся настолько слабыми, что молекулы начинают быстро отдаляться друг от друга, образуя газообразное состояние.
Понятие "температуры кипения" и ее зависимость от атмосферного давления

Однако, важно отметить, что температура кипения может меняться в зависимости от атмосферного давления. Чем выше давление, тем выше температура кипения, и наоборот. Например, при низких атмосферных давлениях, таких как на большой высоте в горах или в космосе, температура кипения воды становится ниже обычного значения при нормальном атмосферном давлении.
Зависимость температуры кипения от атмосферного давления можно объяснить следующим образом: когда вещество нагревается, его молекулы начинают быстрее двигаться и отделяться от друг друга. При достижении определенной критической энергии, молекулы начинают переходить в газообразное состояние и образуют пар. При повышении давления, молекулы вещества подвергаются силе сдавливания, что затрудняет их переход в газообразное состояние. Следовательно, для перехода вещества в газообразное состояние требуется больше энергии, то есть более высокая температура.
Знание зависимости температуры кипения от атмосферного давления является важным, особенно при проведении экспериментов в химической лаборатории или при приготовлении пищи. Также, это явление имеет практическое значение в промышленности, например, при процессах сушки или дистилляции.



