Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), являются одной из самых важных групп элементов в периодической таблице химических элементов. Они называются «щелочными» в связи с их реакцией с водой и образованием щелочных растворов. Несмотря на их важность, щелочные металлы имеют несколько особенностей, о которых нужно знать, чтобы правильно хранить и использовать их.
Первым вопросом, который возникает при работе с щелочными металлами, является их хранение. По своей природе, эти металлы имеют высокую активность и реагируют с кислородом и влагой в воздухе. Поэтому, для их хранения необходимо принять определенные меры. Чаще всего, щелочные металлы хранятся в специальных контейнерах, наполненных инертным газом, таким как аргон или гелий, чтобы предотвратить реакцию с воздухом. Кроме того, важно хранить щелочные металлы в сухом месте, чтобы избежать их контакта с водой и влажностью, которая может привести к аварийной реакции.
Название щелочных металлов имеет свое происхождение, основанное на их основных свойствах. Изначально, эти элементы были названы «щелочными», потому что их гидроксиды (щелочи) обладают щелочной реакцией. Например, гидроксид натрия, известный как пищевая сода, широко используется в кулинарии и бытовых целях. Однако, само название "щелочные" может быть немного вводящим в заблуждение, так как эти металлы также обладают высокой активностью.
Хранение щелочных металлов: рекомендации и советы

Для хранения щелочных металлов необходимо принять ряд предосторожностей и следовать определенным рекомендациям:
- Хранить в инертной среде: Щелочные металлы должны храниться под слоем инертного газа, такого как аргон или ксенон. Это помогает предотвратить их реакцию с водой или кислородом в воздухе.
- Хранить в специальных контейнерах: Щелочные металлы должны быть хранены в специальных контейнерах, которые не реагируют с ними. Более того, контейнеры должны быть герметичными, чтобы предотвратить доступ воздуха и влаги.
- Хранить в прохладном и сухом месте: Щелочные металлы должны быть хранены в прохладном и сухом месте, чтобы предотвратить их окисление или реакцию с влагой.
- Избегать контакта с водой или кислородом: Щелочные металлы должны быть защищены от контакта с водой или кислородом. Прикосновение к воде может вызвать сильную реакцию, проявляющуюся выделением газа или даже воспламенением.
- Хранить в защитной упаковке: Щелочные металлы могут быть хранены в защитной упаковке, такой как вакуумная упаковка или упаковка в инертном газе. Это дополнительно поможет предотвратить их окисление или реакцию с влагой или кислородом.
Следование этим рекомендациям поможет обезопасить хранение щелочных металлов и предотвратить возможные аварийные ситуации. Важно помнить, что работа с щелочными металлами требует серьезного подхода и соблюдения правил безопасности.
Как правильно хранить щелочные металлы

Как правило, щелочные металлы хранятся в специальных контейнерах, чтобы предотвратить их реакцию с влагой и кислородом из воздуха. Обычно это металлические контейнеры или стеклянные ампулы, запаянные таким образом, чтобы предотвратить воздействие внешней среды. Для защиты от влаги и кислорода внутри контейнера можно применять инертные газы, такие как аргон или ксенон.
| Металл | Символ | Свойства | Методы хранения |
|---|---|---|---|
| Литий | Li | Мягкий, легкий, реактивный с водой | Хранить в неактивной среде, например, в аргоне или ксеноне |
| Натрий | Na | Мягкий, реактивный с водой и кислородом | Хранить в неактивной среде, например, в аргоне или ксеноне |
| Калий | К | Мягкий, реактивный с водой и кислородом | Хранить в неактивной среде, например, в аргоне или ксеноне |
| Рубидий | Rb | Мягкий, реактивный с водой и кислородом | Хранить в неактивной среде, например, в аргоне или ксеноне |
| Цезий | Cs | Мягкий, реактивный с водой и кислородом | Хранить в неактивной среде, например, в аргоне или ксеноне |
| Франций | Fr | Мягкий, реактивный с водой и кислородом | Хранить в неактивной среде, например, в аргоне или ксеноне |
Хранение щелочных металлов требует особой осторожности, так как они являются очень реактивными. Контейнеры должны быть плотно закрыты и храниться в сухом месте с минимальной влажностью. Также рекомендуется хранить щелочные металлы вдали от источников огня, так как они могут воспламениться при контакте с водой или воздухом.
При хранении щелочных металлов необходимо соблюдать все необходимые меры предосторожности и инструкции производителя. В случае возникновения проблем или вопросов рекомендуется обратиться к специалистам для получения дополнительной информации.
Щелочные металлы: опасность и меры безопасности

Взаимодействие щелочных металлов с воздухом и водой может быть заметно взрывоопасным. Поэтому при хранении данных веществ необходимо соблюдать определенные меры безопасности:
- Щелочные металлы должны храниться в специальных контейнерах, которые могут выдерживать их высокую реактивность. Такие контейнеры изготавливают из материалов, которые не реагируют с щелочными металлами, например, из стекла или специальных пластиков.
- Хранение щелочных металлов следует производить в хорошо вентилируемом помещении, чтобы избежать скопления опасных газов в случае реакции с воздухом.
- Щелочные металлы необходимо хранить отдельно от других веществ, чтобы избежать непредвиденных химических реакций. Они могут быть размещены на специальных полках или в шкафу, предназначенном только для хранения щелочных металлов.
- Перед использованием щелочных металлов необходимо выполнить обучение персонала, чтобы избежать несчастных случаев и предотвратить реакции с водой или другими веществами.
- При работе с щелочными металлами необходимо соблюдать правила личной гигиены и носить специальную защитную одежду, включая рукавицы, защитные очки и фартук.
Соблюдение этих мер безопасности поможет предотвратить несчастные случаи и повысить безопасность при работе с щелочными металлами. Необходимо всегда помнить об их реактивности и потенциальной опасности, чтобы минимизировать риски и обеспечить безопасность для себя и окружающих.
Характеристики и физические свойства щелочных металлов

У щелочных металлов есть несколько общих характеристик и физических свойств, которые делают их уникальными:
1. Мягкость и низкая плотность: Щелочные металлы - самые мягкие металлы из всех известных элементов. Они легко режутся ножом и могут быть прокатаны в тонкие листы.
2. Низкая температура плавления и кипения: Щелочные металлы имеют относительно низкую температуру плавления и кипения. Например, калий плавится при температуре всего 63 градусов Цельсия (°C).
3. Активность и реактивность: Щелочные металлы являются очень активными химическими элементами. Они легко реагируют с кислородом из воздуха и могут воспламеняться. Кроме того, они реагируют с водой, выделяя водород и образуя щелочные растворы.
4. Хорошая электропроводность: Щелочные металлы хорошие проводники электричества. Они обладают высокой электропроводностью как в твердом, так и в расплавленном состояниях.
5. Образование исковерканных поверхностей: Когда щелочные металлы окисляются или реагируют с водой, их поверхность становится матовой и исковерканной.
6. Высокая химическая реактивность: Щелочные металлы обладают высокой реакционной способностью и часто используются в различных химических реакциях и процессах.
Эти уникальные характеристики и физические свойства делают щелочные металлы важными и полезными элементами во многих областях науки и промышленности.
Химические реакции и взаимодействие щелочных металлов
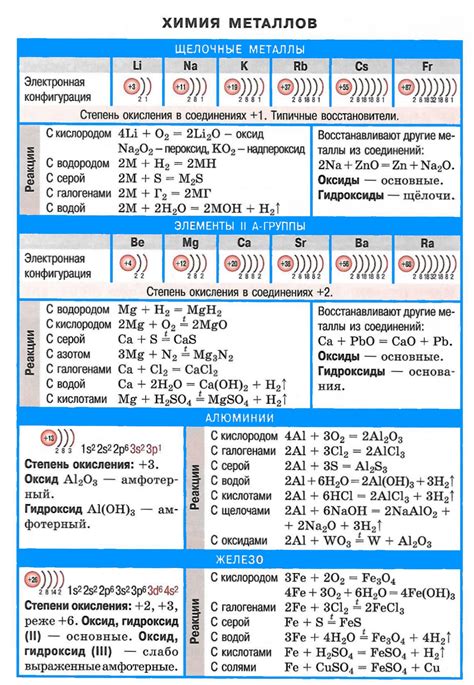
Химические реакции щелочных металлов в основном связаны с их способностью образовывать ионные связи. Когда металл вступает в контакт с другим веществом, происходит обмен электронами, что приводит к образованию ионов и образованию новых соединений.
Взаимодействие щелочных металлов с водой является одной из наиболее известных их реакций. При этом образуются гидроксиды металлов и выделяется водород. Например, реакция натрия с водой происходит с выделением большого количества тепла:
2Na + 2H2O → 2NaOH + H2
Это реакция экзотермическая и может проявляться в виде выделения огня или пламени. Также щелочные металлы нередко реагируют с кислородом из воздуха, образуя оксиды металлов. Например, литий горит при контакте с воздухом и образует литиевый оксид (Li2O).
Взаимодействие щелочных металлов с кислородосодержащими соединениями также может быть взрывоопасным. Например, реакция калия с хлором протекает с выделением большого количества энергии и образованием хлорида калия:
2K + Cl2 → 2KCl
Так же щелочные металлы реагируют с кислотами, образуя соль и выделяя водород газ. Например, реакция натрия с соляной кислотой протекает следующим образом:
2Na + 2HCl → 2NaCl + H2
Обладая высокой реакционной способностью, щелочные металлы легко окисляются воздухом и могут быть поражены водой или влажными средами. Поэтому их хранят в безвоздушных средах, например в масле или карбонате.
Значение названий щелочных металлов

Название "щелочные" они получили из-за способности их оксидов образовывать щелочные растворы при контакте с водой.
Само слово "щелочной" произошло от средневекового арабского слова "al-qaliy", что означает "зола растений". Древние арабские и индийские целители использовали растворы щелочных оксидов, чтобы извлекать ценные металлы из природных источников.
Названия каждого из щелочных металлов – литий, натрий, калий, рубидий, цезий и франций – также имеют свое значение и происхождение.
| Металл | Значение названия |
|---|---|
| Литий | Назван в честь греческого слова "lithos", что означает "камень". Камни и минералы, содержащие литий, были обнаружены в различных регионах мира и использовались в производстве стекла и керамики. |
| Натрий | Название происходит от английского слова "soda", которое в свою очередь имеет латинское происхождение "sodanum" и означает "карбонат натрия". Карбонат натрия был использован в древности для очистки золота и стекла. |
| Калий | Образовано от арабского слова "al qaliy", как и слово "щелочной". Калий использовался в античности для изготовления красок и мыла. |
| Рубидий | Название происходит от латинского слова "rubidus", которое означает "красный". Рубидий обладает интенсивной пурпурной краской, что стало причиной его названия. |
| Цезий | Назван в честь латинского слова "caesius", что также означает "голубой". Цезий имеет голубоватый оттенок, который дал имя металлу. |
| Франций | Получил свое название в честь Франции, где был впервые обнаружен. Франций является самым редким и опасным из щелочных металлов. |
Таким образом, названия щелочных металлов имеют свое историческое и химическое значение, связанное с их свойствами и использованием в прошлом.
Использование и применение щелочных металлов в различных отраслях

Вот несколько из них:
- Электроэнергетика: Батареи на основе лития широко используются в современных портативных электронных устройствах, таких как мобильные телефоны, ноутбуки и электромобили. Щелочные металлы также находят применение в производстве солнечных элементов.
- Металлургия: Натрий используется для удаления кислорода из металлических руд и сплавов, а также для производства алюминия.
- Химическая промышленность: Калий широко используется в качестве пищевой добавки, а также в производстве селитры, удобрений и стекла.
- Фармацевтическая промышленность: Литий используется в качестве компонента лекарственных препаратов, таких как литий-соли, которые применяются при лечении депрессии и биполярного аффективного расстройства.
- Нефтегазовая промышленность: Калий и рубидий используются в процессе бурения скважин для определения наличия нефти и газа.
Это лишь несколько примеров использования щелочных металлов в различных отраслях. Данные металлы имеют широкий спектр применения и играют важную роль в современном мире в различных сферах жизни и науки.



