Константа скорости реакции – это параметр, который характеризует скорость протекания химической реакции. Она остается постоянной при изменении концентрации реагентов. Рассмотрим, почему это так.
Первым фундаментальным принципом, который лежит в основе константы скорости, является принцип активных комплексов. Согласно данному принципу, скорость реакции зависит только от концентраций реагирующих веществ, а не от концентрации активных комплексов. Активный комплекс – это временно образующаяся структура, которая образуется при столкновении реагентов и начинает претерпевать дальнейшие изменения, ведущие к образованию продуктов.
Таким образом, даже если изменить концентрацию реагентов, активные комплексы образуются с такой же скоростью. Константа скорости выражает именно эту скорость образования активных комплексов. Именно поэтому она остается неизменной при изменении концентрации реагентов.
Константа скорости играет ключевую роль в химических расчетах и определении характера химической реакции. Ее значением можно оценить, как быстро происходят химические превращения, и определить идеальные условия для получения продуктов. Поэтому стабильность константы скорости и ее независимость от концентрации – важные факторы, которые определяют прогресс и результаты химических реакций.
Роль константы скорости

Константа скорости определяется экспериментально и может быть различной для разных реакций. Она выражается в виде математического выражения, зависящего от концентрации реагентов и других параметров, таких как температура и давление. Однако, важно отметить, что константа скорости не изменяется при изменении концентраций реагентов, если мы рассматриваем тот же набор реагентов.
Это означает, что при увеличении или уменьшении концентрации реагентов, скорость химической реакции будет изменяться, но константа скорости останется постоянной. Это связано с тем, что константа скорости является интегральной характеристикой реакции, которая зависит от ее молекулярного механизма и структуры молекул реагентов.
Таким образом, константа скорости играет важную роль в химических реакциях, позволяя нам оценить скорость реакции и понять ее механизм. Она также позволяет установить связь между концентрацией реагентов и скоростью реакции, что имеет большое значение для разработки и оптимизации химических процессов.
Концентрация и скорость химической реакции
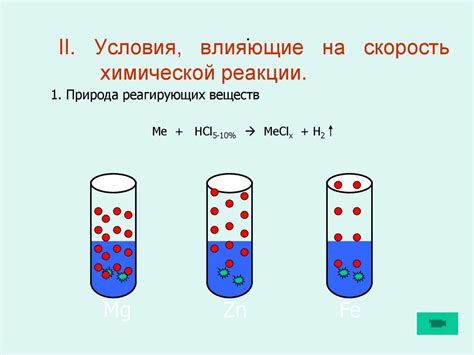
Концентрация вещества играет важную роль в химических реакциях. Концентрация определяет количество вещества, содержащегося в определенном объеме реакционной среды. Она измеряется в молях вещества на литр реакционной среды или в граммах вещества на литр реакционной среды.
Скорость химической реакции, с другой стороны, определяет, как быстро реагенты превращаются в продукты. Скорость реакции зависит от ряда факторов, таких как температура, давление и присутствие катализаторов. Однако, константа скорости реакции - это величина, которая не зависит от концентрации реагентов.
| № | Реагенты | Константа скорости, k |
|---|---|---|
| 1 | A + B -> C | 0.01 |
| 2 | 2A + B -> D | 0.01 |
| 3 | A + 2B -> E | 0.01 |
В таблице показаны примеры химических реакций, где различные реагенты образуют разные продукты, но имеют одинаковую константу скорости. Это означает, что независимо от концентрации реагентов, скорость реакции будет одинаковой. Константа скорости является постоянной характеристикой реакции и зависит только от ее механизма, температуры и присутствия катализатора.
Таким образом, хотя концентрация реагентов влияет на скорость реакции в общем, константа скорости освобождается от этого влияния и остается постоянной. Изменение концентрации реагентов повлияет на время, необходимое для достижения равновесия, но не на константу скорости самой реакции.
Термодинамические законы реакции

Первый закон термодинамики, также известный как закон сохранения энергии, утверждает, что энергия не создается и не уничтожается, а только превращается из одной формы в другую. В контексте реакций это означает, что общая энергия системы должна оставаться постоянной. Если реакция происходит с увеличением энергии, это означает, что система поглощает энергию из окружающей среды, а если реакция сопровождается выделением энергии, она передает энергию окружающей среде.
Второй закон термодинамики утверждает, что в изолированной системе энтропия всегда увеличивается или остается постоянной. Энтропия представляет собой меру беспорядка или хаоса в системе. В контексте реакций, это означает, что в ходе реакции может происходить только превращение веществ в большее количество более "беспорядочных" состояний.
Термодинамические законы позволяют установить, что константа скорости реакции не зависит от концентрации реагентов. Это связано с тем, что константа скорости определяется равновесием между скоростью превращения реагентов в продукты и обратной реакцией. Константа скорости зависит только от температуры и энергетических условий системы, но не от количества веществ, участвующих в реакции. Таким образом, изменение концентрации реагентов не влияет на константу скорости.
Эффект от концентрации реагентов

Это может показаться странным, но объяснение этому явлению кроется в самом определении константы скорости реакции. Константа скорости (k) характеризует только химическую реакцию в целом и зависит от таких факторов, как температура и катализаторы.
Действительно, при изменении концентрации реагентов происходят изменения в натуральной логарифмической формуле скорости реакции, которая включает константу скорости и степени реагентов. Однако, при решении уравнений скорости реакции, константа скорости сокращается, оставляя только степени реагентов и концентрации. Таким образом, значение константы скорости остается неизменным независимо от концентрации реагентов.
Важно отметить, что несмотря на то, что константа скорости не зависит от концентрации реагентов, изменение концентрации может влиять на скорость реакции. Увеличение концентрации реагентов может увеличить вероятность столкновений между частицами реагентов, что в свою очередь повышает скорость реакции. Однако, это влияние концентрации не отражается на значении константы скорости.
Таким образом, эффект от концентрации реагентов на скорость реакции может быть объяснен без изменения значения константы скорости. Изменение концентрации влияет на частоту столкновений между реагентами, но константа скорости остается постоянной и зависит от других факторов химической реакции.
Кинетическая теория реакции
Согласно кинетической теории реакции, скорость химической реакции зависит от количества сталкивающихся молекул с достаточной энергией для преодоления активационного барьера. Однако константа скорости, которая определяет скорость реакции при определенных условиях (температуре, давлении и концентрации), не зависит от концентрации реагентов.
Это объясняется тем, что константа скорости является мерой вероятности возникновения столкновения молекул с определенной энергией и ориентацией, не зависимо от их концентрации. Количество столкновений между молекулами с достаточной энергией зависит от концентрации реагентов, но вероятность того, что молекулы соответствующим образом столкнутся и энергия столкновения будет достаточной для преодоления активационного барьера, остается неизменной.
Таким образом, константа скорости является интегральной характеристикой реакции, зависящей от энергетических характеристик столкновений молекул, а не от изменения количества реагентов. Это позволяет использовать константу скорости для определения механизма реакции и ее стереохимии, а также для сравнения скоростей различных реакций и оценки эффективности катализаторов.



