Катализатор – это вещество, которое ускоряет химические реакции, но при этом не участвует полностью в собственной реакции и остается неизменным по окончании процесса. Однако, несмотря на значительную роль катализатора в скорости процессов, он не оказывает влияния на тепловой эффект реакции.
Тепловой эффект реакции – это количество энергии, которое участвует в образовании или разрушении химических связей веществ, участвующих в реакции. Она может быть положительной (эндотермической) или отрицательной (экзотермической), в зависимости от того, поглощается или выделяется энергия в процессе.
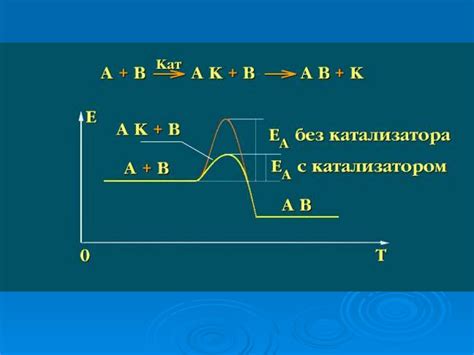
Однако, катализатор не влияет на этот тепловой эффект, потому что его основное действие направлено на изменение активационной энергии реакции – энергии, которая необходима для преодоления барьера активации и начала реакции.
Таким образом, катализаторы обеспечивают более быстрое протекание реакции, но не изменяют энергию, которая выделяется или поглощается в ходе процесса. Поэтому, при использовании катализатора, тепловой эффект реакции остается неизменным, и происходит только изменение скорости ее протекания. Это делает катализаторы весьма полезными инструментами для контроля химических процессов и увеличения эффективности их проведения.
Влияние катализатора на тепловой эффект
Катализатор – вещество, которое ускоряет химическую реакцию, но при этом не изменяется само. Катализаторы позволяют снизить энергию активации, необходимую для протекания реакции, и повысить скорость химических превращений. Однако они не участвуют в реакции напрямую и не претерпевают химические изменения.
При проведении реакции с использованием катализатора, тепловой эффект обычно не учитывается. Это связано с тем, что катализаторы не влияют на энергию активации, а только ускоряют процесс реакции, изменив путь протекания реакции через образование промежуточных стадий.
Таким образом, наличие катализатора не изменяет термодинамические параметры реакции, такие как стандартная энтальпия реакции, стандартная энтропия реакции и стандартный тепловой эффект реакции. Катализаторы оказывают влияние только на скорость протекания реакции, не влияя на ее тепловой баланс.
Таким образом, использование катализаторов позволяет повысить скорость реакции, не изменяя ее теплового эффекта. Это делает катализаторы важным инструментом в синтезе органических соединений, производстве топлива и других отраслях химической промышленности.
Реакции, сопровождающиеся выделением тепла

Во время химических реакций может происходить выделение или поглощение тепла. Реакции, сопровождающиеся выделением тепла, называются экзоэнергоническими. В таких реакциях энергия системы передается окружающей среде в форме тепла. Тепловой эффект экзоэнергонической реакции всегда отрицательный, так как система теряет энергию.
Самый известный пример экзоэнергонической реакции - горение. При горении реагенты окисляются, а окружающая среда поглощает выделяющуюся при этом энергию в виде тепла и света. Также к этой категории реакций относится множество промышленных процессов, таких как взрывы, некоторые электрохимические реакции и т.д.
Выделение тепла в экзоэнергонической реакции не зависит от присутствия или отсутствия катализатора. Как правило, катализатор ускоряет реакцию, но не влияет на тепловой эффект. Он не увеличивает и не уменьшает количество энергии, выделяющейся или поглощающейся в результате реакции.
Реакции, сопровождающиеся поглощением тепла
В некоторых химических реакциях происходит поглощение тепла, то есть окружающая среда передает энергию реагирующим веществам. Такие реакции называются эндотермическими реакциями. В процессе эндотермической реакции возникает потребность во внешнем источнике тепла, чтобы реакция смогла протекать.
Одним из примеров реакции с поглощением тепла является реакция сжигания углерода:
| Уравнение реакции | Тепловой эффект (ΔH) |
|---|---|
| C + O2 → CO2 | +393,5 кДж/моль |
Тепловой эффект реакции сжигания углерода положительный, что указывает на поглощение тепла в процессе реакции. Это означает, что для осуществления реакции необходимо постоянное поступление энергии в виде тепла из окружающей среды.
Такие реакции нередко используются в промышленности. Например, реакция химического синтеза аммиака (NH3):
| Уравнение реакции | Тепловой эффект (ΔH) |
|---|---|
| N2 + 3H2 → 2NH3 | -92,4 кДж/моль |
В данной реакции также наблюдается поглощение тепла, что означает необходимость поддержания определенной температуры и постоянной подачи тепла для обеспечения протекания реакции.
Механизмы катализа
| Механизм | Описание |
|---|---|
| Катализ преобразования реагентов | Катализатор взаимодействует с реагентами, изменяя их энергетический профиль и снижая энергетический барьер реакции. Это позволяет реагентам проходить через переходное состояние быстрее. |
| Катализ образования промежуточного соединения | Катализатор образует соединение с реагентами и создает стабильное промежуточное состояние. Это промежуточное состояние ускоряет процессы реакции, так как у него ниже энергия активации, чем у исходных веществ. |
| Катализ реорганизации молекул | Катализатор стабилизирует переходные состояния реакции, способствуя реорганизации связей и образованию новых продуктов. Это позволяет ускорить реакцию путем оптимизации геометрии и энергетики молекул. |
Поэтому катализаторы не влияют на тепловой эффект реакции, так как их действие направлено только на ускорение скорости реакции, не изменяя энергетических изменений происходящей химической реакции.
Роль катализатора в реакционном процессе
Активация реагентов: Катализатор способен активировать реагенты, уменьшая энергию активации, необходимую для начала реакции. Это достигается подстройкой энергетических уровней реагентов, таким образом, обеспечивая их коллизию и эффективное взаимодействие.
Ускорение химических превращений: Катализатор активирует процесс реакции, увеличивая скорость образования конечных продуктов. Он может действовать, устраняя промежуточные стадии реакции, стабилизируя промежуточные комплексы или изменяя механизм реакции. Катализаторы обычно повышают скорость реакции в несколько раз или даже значительно больше, сокращая время реакции.
Облегчение переходов между состояниями: Катализатор может обладать способностью облегчать переход реагентов от одного состояния к другому. Он может изменять структуру реагентов, провоцировать изменение активных центров или взаимодействовать с реакционными индифферентными частицами.
Увеличение конверсии: Катализатор также может увеличить конверсию реакционной смеси, что означает, что большее количество реагентов будет превращено в продукты. Это происходит путем изменения равновесия реакции, смещая его в сторону продуктов. Катализатор может повышать конверсию, обеспечивая дополнительные реакционные пути или снижая потери реагентов в побочные реакции.
Функционирование в цикле: Катализатор продолжает функционировать в реакционном процессе, не изменяясь в химическом составе. Он может быть использован во множестве реакций, что делает его экономически выгодным и эффективным.
В целом, роль катализатора в реакционном процессе заключается в ускорении химических превращений, облегчении переходов между состояниями, увеличении конверсии и функционировании в цикле. Катализаторы играют важную роль в промышленных процессах и множестве других химических реакциях, повышая их эффективность и энергетическую экономику.
Как катализатор влияет на тепловой эффект реакции?
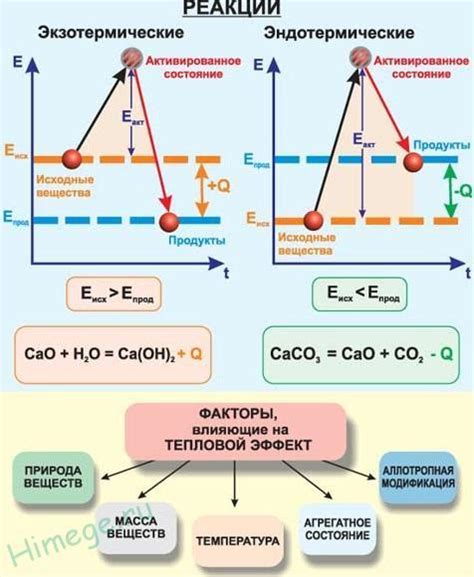
Тепловой эффект реакции определяет, сколько тепла поглощается или выделяется в процессе химической реакции. Катализаторы играют важную роль в ускорении химических реакций, однако они не влияют на тепловой эффект.
Во время реакции энергетические связи входящих веществ разрываются, затем образуются новые связи для образования продуктов реакции. Данный процесс сопровождается поглощением или выделением тепла – энергии реакции.
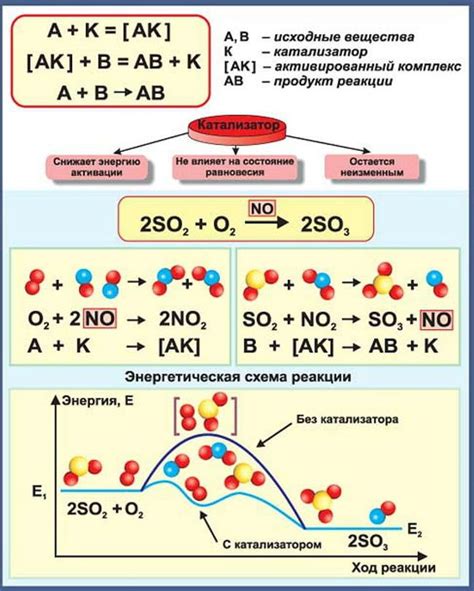
Катализаторы обладают способностью ускорять скорость химической реакции, не потребляясь в процессе. Они достигают этого за счет уменьшения энергетического барьера, который необходимо преодолеть молекулам реагентов для образования продуктов. Катализаторы снижают энергию активации реакции, что позволяет молекулам сталкиваться эффективнее и увеличивает вероятность образования продуктов.
Однако катализаторы не изменяют энергетические связи в веществах, которые участвуют в реакции. Поэтому они не оказывают прямого влияния на энергию образующихся и разрывающихся связей. Тепловой эффект реакции зависит от разности энергии связей между реагентами и продуктами и не изменяется под влиянием катализатора.
Таким образом, хотя катализаторы могут ускорить реакцию, они не влияют на тепловой эффект, который определяется только энергетическими связями между веществами.
Снижение активационной энергии
Катализаторы могут предоставлять замощенные поверхности, на которых происходят реакции, или изменять энергетические уровни реагентов и продуктов, что позволяет уменьшить активационную энергию реакции. После поглощения энергии от катализатора, реагенты становятся более подвижными и могут взаимодействовать с большей вероятностью, что приводит к увеличению числа успешных соударений и скорости реакции.
Снижение активационной энергии позволяет реакции протекать при более низкой температуре и с меньшим количеством энергии, что делает процесс более эффективным и экономичным. Однако, влияние катализатора на тепловой эффект реакции минимально или вообще отсутствует, так как катализатор не участвует в начальных или конечных реакциях и не изменяет общую энергию реакционной смеси.
Равновесная константа реакции

Равновесная константа реакции зависит только от коэффициентов активности веществ и температуры, и не зависит от давления и начальных концентраций реагентов.
Значение равновесной константы реакции может быть использовано для определения положения равновесия. Если значение Keq больше единицы, то в состоянии равновесия преобладают продукты реакции. Если значение Keq меньше единицы, то в состоянии равновесия преобладают реагенты.
Катализатор, влияя на скорость реакции, не изменяет значение равновесной константы. Он оказывает свое действие на прямую и обратную реакцию, ускоряя обе процессы. Таким образом, хотя на скорость реакции катализатор влияет, на равновесную константу он не влияет.
Изменение характеристик катализатора

Катализаторы могут быть изменены или модифицированы, чтобы получить оптимальную эффективность. Различные характеристики катализатора, такие как поверхностная активность, размер частиц и способность к обратной реакции, могут быть модифицированы с помощью различных методов.
Одним из методов модификации катализатора является введение промежуточных слоев или покрытий на поверхность катализатора. Это может увеличить его активность и селективность. Например, металлические катализаторы могут быть покрыты тонким слоем активного металла для повышения их активности и стабильности.
Еще одним методом модификации катализатора является изменение его структуры. Например, поверхность катализатора может быть изменена с помощью окисления или восстановления, что может влиять на его активность и специфичность.
Размер частиц катализатора также может быть регулирован. Уменьшение размера частиц может увеличить активную поверхность катализатора и, следовательно, улучшить его эффективность.
Катализаторы также могут быть модифицированы путем введения дополнительных компонентов. Например, добавление промежуточных соединений или помощников катализатора может улучшить его активность и селективность.
Все эти методы модификации катализатора могут быть использованы для достижения оптимальных характеристик и повышения эффективности тепловых реакций в промышленных процессах.



