Окраска растворов кислот является фундаментальным явлением в химии. Когда мы добавляем индикатор в кислотный раствор, происходит химическая реакция, которая меняет его окраску. Это явление широко изучается в химических лабораториях и играет важную роль в определении качества и концентрации кислотных растворов.
Главной причиной изменения окраски раствора кислоты при добавлении индикатора является изменение концентрации или соотношения ионов в растворе. Индикаторы - это вещества, которые изменяют свою окраску в зависимости от pH значения раствора. Конкретный вид индикатора определяет диапазон pH, в котором происходит изменение его окраски.
Механизм изменения окраски раствора при добавлении индикатора связан с изменением структуры молекулы индикатора, в результате чего меняется спектральные свойства вещества. Обычно это происходит за счет протонирования или депротонирования молекулы индикатора в зависимости от pH. Процесс протонирования и депротонирования приводит к изменению цвета индикатора и, следовательно, к изменению окраски кислотного раствора.
Изменение окраски раствора кислоты при добавлении индикатора
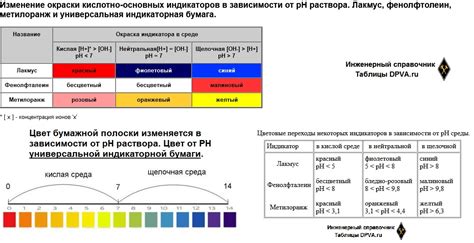
При добавлении индикатора в раствор кислоты происходит химическая реакция между индикатором и ионами водорода. Индикатор – это вещество, которое меняет свой цвет в зависимости от pH раствора и способно указывать на его кислотность или щелочность.
При изменении концентрации ионов водорода меняется структура индикатора, что приводит к изменению его цвета. Это происходит из-за различной полярности и зарядности молекул индикатора в зависимости от pH окружающей среды.
Например, в нейтральной среде индикатор может иметь другую структуру и окрашиваться в определенный цвет, а в щелочной или кислой среде – в другой цвет или не окрашиваться вовсе.
Таким образом, изменение окраски раствора кислоты при добавлении индикатора происходит из-за влияния концентрации ионов водорода на структуру и свойства молекул индикатора. Это явление широко используется в химическом анализе и в лабораторных условиях для определения pH значения растворов.
Причины изменения окраски
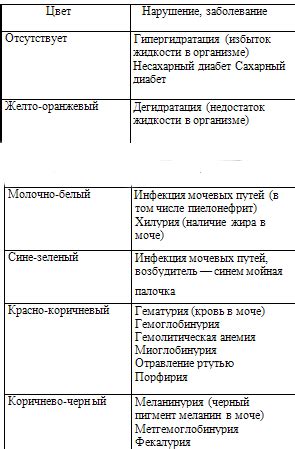
Когда кислота добавляется к раствору, происходит реакция с веществами в растворе, которая может привести к изменению окраски. Это может быть связано с изменением концентрации ионов водорода (H+) в растворе.
Индикаторы могут менять свою окраску в зависимости от концентрации H+. Например, индикаторы типа фенолфталеина становятся розовыми в щелочных условиях и безцветными или слабо окрашенными в кислотных условиях.
Изменение окраски раствора при добавлении индикатора позволяет определить pH среды. Механизм этого изменения окраски может быть связан с изменением растворимости или структуры молекулы индикатора под влиянием кислоты.
Механизмы изменения окраски

Изменение окраски раствора кислоты при добавлении индикатора обусловлено несколькими факторами. У индикаторов есть свойство изменять свою структуру и окраску в зависимости от pH окружающей среды. Этот процесс происходит благодаря наличию в молекуле индикатора специальных групп, называемых флуорофорами.
Флуорофоры в молекуле индикатора обладают способностью поглощать энергию света и испускать ее с другой длиной волны. Это явление называется флуоресценцией. Цвет индикатора определяется длиной волны, которую он поглощает и испускает. При изменении pH раствора меняется и свойство индикатора флуоресцировать, что влияет на его окраску.
Механизм изменения окраски раствора кислоты при добавлении индикатора можно объяснить с помощью концепции индикаторных форм. Когда индикатор находится в кислой среде, он находится в форме, которая имеет одну окраску. При добавлении индикатора в раствор кислоты происходит смешивание его с кислой средой, и индикатор переходит в нейтральную среду. В нейтральной среде индикатор принимает другую форму, имеющую другую окраску. Этот процесс можно представить с помощью таблицы, в которой указаны различные формы индикатора и их окраски при разных pH значений.
| Форма индикатора | Окраска | pH среды |
|---|---|---|
| Форма 1 | Красный | Кислая среда |
| Форма 2 | Зеленый | Нейтральная среда |
| Форма 3 | Синий | Щелочная среда |
Таким образом, изменение окраски раствора кислоты при добавлении индикатора обусловлено флуоресценцией и изменением форм молекулы индикатора в зависимости от pH среды.
Виды индикаторов
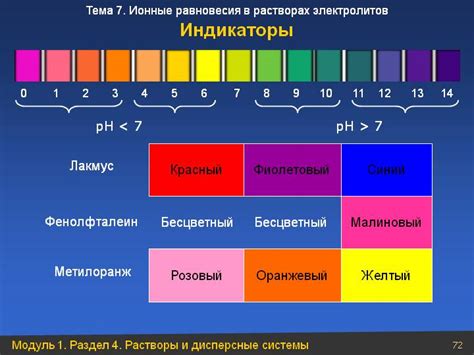
- Универсальные индикаторы: такие индикаторы меняют цвет при любых изменениях pH. Они представляют собой смесь нескольких веществ, которые при взаимодействии с кислотами и щелочами сразу же меняют окраску.
- Специфические индикаторы: эти индикаторы реагируют только на определенные изменения pH. Они используются при работе с растворами конкретных кислот и щелочей, так как дают наиболее точные результаты.
- Фотометрические индикаторы: данные индикаторы меняют свою окраску в зависимости не только от pH, но и от интенсивности света, проходящей через раствор.
- Оптические индикаторы: индикаторы данного типа используются для видимого наблюдения изменений pH. Они меняют свой цвет от одного края спектра до другого.
Каждый из этих видов индикаторов имеет свои преимущества и недостатки, и выбор индикатора зависит от конкретной ситуации и требуемой точности анализа.
Применение индикаторов
Индикаторы широко применяются в химических и биологических исследованиях для определения концентрации и pH растворов, а также для оценки химических реакций и процессов.
Одной из основных областей применение индикаторов является аналитическая химия, где они используются для качественного и количественного определения различных веществ и ионов в пробах.
Индикаторы также широко применяются в биологии и медицине. Например, они могут использоваться для определения pH в тканях или жидкостях организма, для определения наличия определенных веществ или микроорганизмов.
В промышленности индикаторы могут использоваться для контроля качества продуктов, определения концентрации веществ в процессе производства, а также для мониторинга и отслеживания различных процессов и производственных условий.
Индикаторы также могут использоваться в образовании и научных исследованиях для демонстрации химических реакций и процессов, а также для изучения основных принципов и законов химии.
В целом, применение индикаторов является важным инструментом в химическом анализе и исследованиях, позволяющим получить качественные и количественные данные о составе и свойствах веществ и реакций.



