Химическая связь – это взаимодействие атомов, ионов или молекул, которое приводит к образованию стабильной однородной системы. Она образуется в результате изменения энергии частиц и обеспечивает устойчивость вещества.
Химическая связь возникает из-за стремления атомов к насыщению электронной оболочки – достижению стабильной конфигурации. При этом атомы либо передают, либо приобретают, либо разделяют электроны. При наличии связи, атомы становятся электронно устойчивыми.
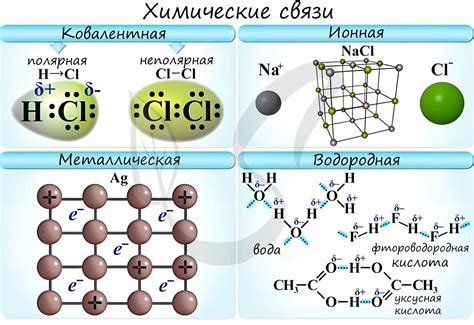
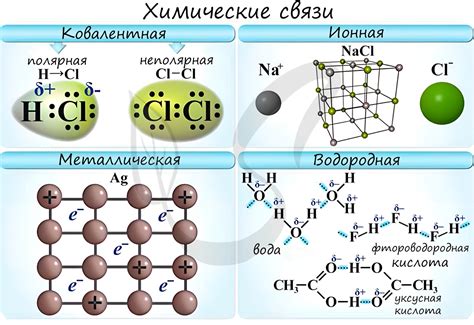
Основные типы химических связей включают ионную, ковалентную и металлическую связи. Ионная связь образуется между ионами с разноименными зарядами, когда электроны передаются от одного атома к другому. Ковалентная связь возникает, когда равные по силе электроны обоих атомов принадлежат им обоим. А при металлической связи насыщается оболочка расположенных на одной плоскости групп атома.
Что такое химическая связь и почему она формируется
Основной причиной формирования химической связи является стремление атомов достичь более стабильного состояния. Атомы стремятся заполнить свои внешние электронные оболочки, чтобы достичь электронной конфигурации с наименьшим уровнем энергии. Для этого они могут передавать, делить или принимать электроны от других атомов.
Существует несколько типов химических связей, включая ионную связь, ковалентную связь и металлическую связь. В ионной связи электроны переносятся от одного атома к другому, образуя положительно и отрицательно заряженные ионы, которые притягиваются друг к другу. Ковалентная связь формируется, когда атомы обменивают электроны и создают общую пару электронов между собой. В металлической связи электроны свободно передвигаются между атомами и образуют облако электронов.
Химическая связь играет важную роль в химических реакциях и определяет физические и химические свойства веществ. Она обеспечивает стабильность молекул и кристаллов и позволяет им существовать в определенной форме. Без химической связи не было бы возможности образования и существования сложных структур и соединений, которые обладают разнообразными свойствами и могут выполнять различные функции.
- Химическая связь формируется в результате взаимодействия валентных электронов.
- Она возникает из стремления атомов достичь более стабильного состояния.
- Различные типы химических связей включают ионную, ковалентную и металлическую связи.
- Химическая связь определяет физические и химические свойства веществ.
- Она позволяет образованию и существованию сложных структур и соединений.
Определение и сущность химической связи
Сущность химической связи заключается в стремлении атомов к достижению наиболее энергетически выгодного состояния. Атомы, имеющие неполное заполнение электронной оболочки, стремятся заполнить её до определенного числа электронов, следуя правилу октаетрии, то есть иметь 8 электронов во внешней оболочке. Для добивания этой цели атомы могут обменивать, делить или принимать электроны от других атомов.
В химической связи атомы объединяются в очень близком расстоянии и таким образом образуют молекулы или кристаллические решетки. Часто в химической связи между атомами происходит обмен электронами, что ведет к появлению положительно и отрицательно заряженных ионов. Количество электронов, участвующих в химической связи между двумя атомами, называется валентностью.
Химическая связь играет важную роль во многих аспектах химии. Она определяет свойства и структуру химических соединений и способствует образованию новых веществ. Благодаря химической связи возможно создание разнообразных материалов, лекарственных препаратов, синтез новых веществ и разработка различных химических реакций.
Электронная структура и роль электронов в химической связи
Электронная структура атома определяется его распределением электронов по энергетическим уровням (оболочкам) и подуровням. Наиболее близки к ядру находятся энергетически более низкие уровни, а дальше от ядра расположены более высокие уровни.
В химической связи электроны могут быть перенесены от одного атома к другому, образуя ионные связи. В этом случае один атом отдает электрон(ы), приобретая положительный заряд, а другой атом принимает электрон(ы), приобретая отрицательный заряд. Таким образом, образуется притяжение между положительно и отрицательно заряженными ионами, что и создает ионную связь.
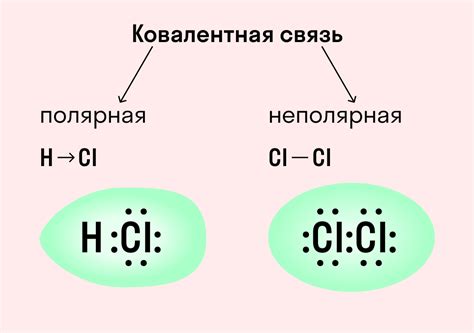
Однако большинство химических связей, особенно в молекулярных соединениях, образуются через совместное использование электронов, которое называется ковалентной связью. Атомы, объединяясь в молекулу, совместно используют свои электроны, чтобы достичь электронной конфигурации инертного газа. В результате образуются пары электронов, которые существуют в пространстве между атомами.
Ковалентная связь может быть полярной или неполярной. В полярной ковалентной связи электроны проводники более времени рядом с одним атомом, что создает разность электрического заряда и образует полярные молекулы. В неполярной ковалентной связи, электроны равномерно распределены между атмами, и молекула не обладает дипольным моментом.
Таким образом, электронная структура атомов является основой для образования химических связей. Взаимодействие электронов определяет тип связи, ее силу и свойства соединения.
Ионная связь и механизм ее образования
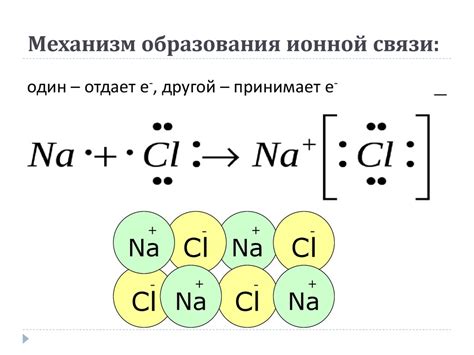
Зачастую ионная связь образуется между атомами металлов и неметаллов. При этом металлы имеют свойство отдавать электроны и становятся положительно заряженными ионами, а неметаллы имеют свойство принимать электроны и становятся отрицательно заряженными ионами.
Этот процесс образования ионной связи осуществляется посредством обмена электронами. Атом металла становится катионом, отдавая свои валентные электроны, а атом неметалла становится анионом, принимая эти электроны. В результате образуется ионы с противоположными зарядами, которые электростатически притягиваются друг к другу и создают ионную связь.
Важно отметить, что ионная связь обладает высокой прочностью и является довольно избирательной. Это означает, что образование ионной связи возможно только между атомами с определенными свойствами: один из атомов должен обладать высокой электроотрицательностью и иметь стремление к приему электронов, в то время как другой атом должен иметь низкую электроотрицательность и быть готовым отдать свои электроны.
Ионная связь является одной из ключевых химических связей во многих соединениях и веществах. Она определяет их устойчивость, реакционную способность и многие физические и химические свойства. Понимание механизма образования ионной связи является важным шагом для изучения химии и понимания многих явлений в природе и науке.
Ковалентная связь и принцип ее формирования
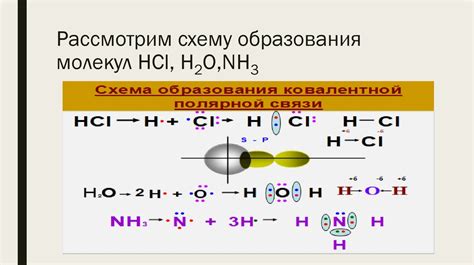
Ковалентная связь образуется, когда два атома делят пару электронов. Каждый атом предоставляет один электрон для образования общей пары. Это происходит потому, что оба атома стремятся достигнуть более стабильного энергетического состояния. Для этого атомы делят электроны, чтобы заполнить свои внешние энергетические оболочки.
Образование ковалентной связи основывается на принципе электронной парности. Атомы с непарными электронами образуют ковалентные связи, чтобы достичь полной электронной окраски, то есть чтобы иметь пары электронов в своих внешних энергетических оболочках. При образовании электронной пары оба атома приобретают более стабильное состояние и некоторую энергию освобождают, что делает процесс образования ковалентной связи энергетически выгодным.
Ковалентные связи широко распространены в ковалентных соединениях, таких как органические соединения. Эти связи имеют силу, основанную на числе общих электронных пар и на длине их связи. Ковалентные связи могут быть одиночными, двойными или тройными. Один электронный пар образует одиночную связь, два электронных пары - двойную связь, а три пары электронов - тройную связь.
Металлическая связь и особенности ее возникновения
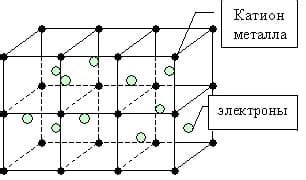
Основной особенностью металлической связи является возможность образования электронного облака, общего для всех атомов металла. В металлах есть "море" свободных электронов, которые формируют электронное облако. Кристаллическая решетка металлов представляет собой регулярный массив положительно заряженных ионов металла, окруженных общими электронами.
Металлическая связь возникает из-за относительно слабого притяжения между положительно заряженными ядрами и общими электронами. Она основывается на модели "электронного газа", где свободные электроны могут свободно передвигаться по кристаллической решетке.
Электронное облако в металле обеспечивает такие физические свойства металлов, как отличная электропроводность и теплопроводность. Кроме того, металлическая связь способствует образованию металлического блеска и характерного металлического благородства.
Важно отметить, что металлическая связь имеет некоторые различия с другими типами химических связей, таких как ионная или ковалентная связь. В ионной связи происходит образование притягивающихся ионов, а в ковалентной связи происходит обмен электронами между атомами. Однако металлическая связь основывается на коллективном движении свободных электронов и положительных ионных ядер.
Гидрофобная связь и ее роль в биологических системах

Главная особенность гидрофобной связи заключается в том, что она образуется исключительно из-за гидрофобных взаимодействий, то есть взаимодействий между неполярными (гидрофобными) участками молекулы или между неполярными участками разных молекул.
Одной из причин образования гидрофобной связи является стремление гидрофобных групп уйти от воды. Вода – полярное растворителю, и гидрофобные группы стремятся избегать контакта с ней. Это приводит к тому, что гидрофобные группы сближаются между собой и образуют связи, которые могут быть слабыми, но оказывают значительное влияние на структуру и функцию молекулы.
Гидрофобная связь играет важную роль, например, в формировании белковой структуры. Белки содержат гидрофобные аминокислотные остатки, и связи между ними способны создавать структуру, которая обеспечивает устойчивость белка и его способность выполнять определенные функции.
Также, гидрофобная связь может быть ответственной за формирование мембран клеток. Гидрофобные хвосты липидов, из которых состоят клеточные мембраны, сближаются друг с другом и формируют двойной липидный слой, который является основным компонентом мембраны. Гидрофобная связь между липидными хвостами обеспечивает целостность мембраны и ее проницаемость для различных веществ.
Таким образом, гидрофобная связь играет важную роль в биологических системах, обеспечивая стабильность и функциональность молекул и структур. Это один из фундаментальных механизмов, которые определяют жизненные процессы организмов.
Ван-дер-Ваальсова связь и ее значение в слабых взаимодействиях

Ван-дер-Ваальсова связь возникает из-за дипольного момента атомов или молекул. Внутри атома или молекулы электроны постоянно двигаются, и на некоторое время их распределение может быть временно неравномерным. Это временное неравномерное распределение создает дипольный момент, который взаимодействует с дипольными моментами соседних атомов или молекул.
Ван-дер-Ваальсова связь часто присутствует в слабых взаимодействиях, таких как взаимодействие между не поляризованными молекулами или между атомами инертных газов. Эта связь играет важную роль в ряде явлений, таких как адгезия, коагуляция, агрегация и дисперсия. Например, ван-дер-Ваальсова связь отвечает за силу, которая делает паутину паука такой прочной и устойчивой к разрыву.
Ван-дер-Ваальсова связь обладает слабой энергией, поэтому она обычно преодолевается при повышении температуры или приложении внешнего воздействия. Однако, несмотря на свою слабую природу, она может играть важную роль в крупномасштабных процессах и является ключевым фактором в определении физических и химических свойств вещества.



