Нитрат-ион - это одна из наиболее известных и широко распространенных неорганических ионов. Нитраты широко используются в промышленности, сельском хозяйстве и медицине, а изучение структуры и свойств нитрат-иона имеет большое значение для химиков и исследователей.
Электрическая зарядность нитрат-иона является ключевой характеристикой. Он имеет общую отрицательную зарядность (-1), что означает наличие избыточного электрона. Для нейтрализации зарядности нитрат-иона требуется один протон, поэтому его также называют моноатомным супероксидом.
Структурная формула нитрат-иона записывается как NO3-. Он состоит из атома азота (N) с тремя атомами кислорода (O), связанных с ними. Это пример аниона, который образуется путем потери одного электрона азотом.
Нитрат-ион: общая информация и химический состав

Основная характеристика нитрат-иона – его отрицательный заряд, который обозначается как -1. Такой заряд обусловлен наличием трех отрицательно заряженных атомов кислорода, связанных с атомом азота. Нитрат-ион обладает линейной геометрией и имеет симметричную структуру, что делает его стабильным и реакционно активным.
Примечание: Нитрат-ион широко используется в различных химических процессах и продуктах. Например, нитраты часто применяются в качестве удобрений в сельском хозяйстве, а также в производстве взрывчатых веществ и пищевых добавок.
Структура и свойства нитрат-иона
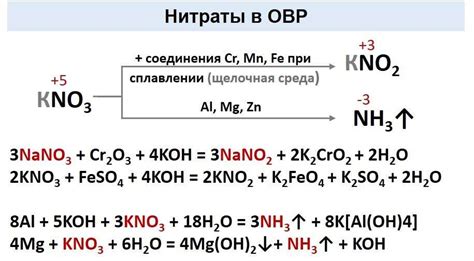
Структура нитрат-иона имеет плоскую треугольную геометрическую форму. Атом азота занимает центральное положение и связан с каждым из трех атомов кислорода с помощью одиночных ковалентных связей. Углы между связями составляют примерно 120 градусов.
Нитрат-ион хорошо растворяется в воде, что делает его полезным в качестве ионного понижителя температуры плавления солей. Он обладает высокой степенью полярности из-за наличия заряда, что способствует его растворимости и способности легко вступать в химические реакции.
Нитрат-ион широко используется в промышленности для производства различных химических соединений, таких как нитраты металлов и азотные удобрения. Кроме того, нитрат-ион широко распространен в природе и может быть образован как результат метаболизма бактерий и растений.
В целом, структура и свойства нитрат-иона делают его важным и полезным соединением в химической и биологической науке, а также в различных промышленных процессах.
Физические и химические характеристики нитрат-иона
Физические характеристики нитрат-иона включают следующие показатели:
| Молекулярная масса | Плотность | Температура плавления | Температура кипения |
|---|---|---|---|
| 62.00 г/моль | 2.04 г/см³ | 271 °C | 440 °C |
Химические характеристики нитрат-иона обусловлены его способностью давать реакции окислительно-восстановительного типа. Нитрат-ион может вступать в реакции с различными веществами, образуя соли нитратов. Нитрат-ионы являются сильными окислителями и могут способствовать горению и окислению других веществ.
Нитраты являются важными веществами в химической промышленности и сельском хозяйстве. Они широко используются в производстве удобрений, взрывчатых веществ и пищевых добавок. Кроме того, нитрат-ионы играют важную роль в экологии, так как могут быть источниками загрязнения водных систем, особенно если их концентрация превышает безопасные пределы.
Количество электронов и протонов в нитрат-ионе

Нитрат-ион (NO3-) состоит из атома азота (N) и трех атомов кислорода (O). Атом азота имеет порядковый номер 7, что значит, что у него 7 электронов. Каждый атом кислорода имеет порядковый номер 8 и, следовательно, 8 электронов.
В нитрат-ионе всего 3 атома кислорода. Поэтому общее количество электронов в нитрат-ионе можно рассчитать следующим образом: (7 электронов у азота) + (8 электронов у каждого из трех атомов кислорода) = 7 + 8 × 3 = 7 + 24 = 31.
Количество протонов в нитрат-ионе равно количеству протонов в атоме азота, так как протоны не участвуют в обмене при образовании иона. Известно, что азот имеет порядковый номер 7, что значит, что у него 7 протонов.
Общие сведения о количестве электронов в нитрат-ионе

В нитрат-ионе азот обладает разносторонними связями с кислородом, и эта особенность делает его стабильным и реакционно способным.
Количество электронов в нитрат-ионе составляет восемь. Атом азота вносит пять электронов, а каждый атом кислорода вносит шесть электронов. Таким образом, общая сумма электронов равна 5 + 6 + 6 + 6 = 23 электрона.
Электроны в нитрат-ионе участвуют в формировании разнообразных химических связей и взаимодействиях с другими атомами и ионами.
Описание количества электронов в нитрат-ионе позволяет лучше понять его свойства и реакционную способность в химических процессах.
Распределение электронов в оболочках атомов нитрат-иона
Нитрат-ион (NO₃⁻) состоит из одного атома азота и трех атомов кислорода. Каждый из этих атомов имеет свою электронную оболочку, на которой расположены электроны.
Атом азота имеет электронную конфигурацию 2,8,5. Это значит, что на его первой оболочке находится 2 электрона, на второй оболочке – 8 электронов, а на третьей оболочке – 5 электронов. Однако, в нитрат-ионе атом азота теряет один из своих электронов и его электронная конфигурация становится 2,7,5. Таким образом, атом азота в нитрат-ионе имеет восемь электронов на второй оболочке и пять электронов на третьей оболочке.
Каждый из трех атомов кислорода в нитрат-ионе имеет электронную конфигурацию 2,6. В результате, каждый атом кислорода имеет шесть электронов на своей второй оболочке.
Таким образом, в нитрат-ионе имеется 23 электрона: 8 электронов на второй оболочке атома азота и 6 электронов на второй оболочке каждого из трех атомов кислорода.
Протоны в нитрат-ионе: свойства и допустимая концентрация
Нитрат-ион образуется путем добавления одной атомной группы к азотному атому, который затем окружается тремя кислородными атомами. Протоны в нитрат-ионе отрицательно заряжены и сбалансированы отрицательным зарядом нитрогенного атома и кислородов.
Допустимая концентрация протонов в нитрат-ионе зависит от условий окружающей среды и может варьироваться. В природных условиях, например, в водных растворах, нитрат-ион может существовать в различных концентрациях, в зависимости от факторов окружающей среды, включая pH-уровень и наличие других химических веществ.
Однако в промышленности и в приложениях, связанных с использованием нитрат-иона, существуют определенные нормы и стандарты, которые регулируют концентрацию протонов и других компонентов вещества. Это необходимо для обеспечения безопасности и качества процессов, в которых используется нитрат-ион.



