Представление об атомах и молекулах неразрывно связано с изучением химии и физики. Вопрос о том, что меньше - атом или молекула, может показаться простым, но на самом деле требует глубокого понимания структуры и свойств вещества.
Атомы и молекулы - это основные строительные блоки материи. Атомы являются элементарными частицами, из которых состоят все вещества. Они имеют ядро, окруженное электронами. Молекулы же образуются при соединении двух или более атомов одного или разных элементов.
Итак, что же меньше - атом или молекула? Ответ на этот вопрос зависит от контекста. В общем случае, атом является более маленьким строительным блоком, поскольку он состоит из единственного ядра и нескольких электронов. Молекула же содержит несколько атомов, поэтому она может иметь больший размер и массу.
Однако существуют случаи, когда молекула может быть меньше, чем атом. Например, молекула водорода (H2) состоит из двух атомов водорода (Н), а каждый атом водорода является меньше по размеру и массе, чем молекула водорода в целом. Таким образом, в данном случае молекула оказывается меньше, чем атом.
Меньше ли атом или молекула и почему?

Молекула, в свою очередь, представляет собой группу атомов, связанных между собой определенными химическими связями. Молекулы могут состоять как из одного вида атомов (например, молекула кислорода O2), так и из разных видов атомов (например, молекула воды H2O).
Теперь давайте попробуем понять, что же меньше - атом или молекула. Во-первых, стоит отметить, что размеры атомов и молекул имеют весьма малые значения и измеряются в нанометрах (1 нанометр = 1 миллиардная часть метра).
Средний диаметр атома составляет около 0,1 нанометра, в то время как размер молекул может варьироваться в широких пределах - от маленьких молекул водорода (около 0,074 нанометра) до огромных белковых молекул (несколько нанометров в диаметре).
Таким образом, можно сказать, что в общем случае атомы меньше молекул. Это связано с тем, что атом является составной частью молекулы и вносит свой вклад в ее размеры.
Атомы vs молекулы: основные понятия

Атомы и молекулы взаимодействуют между собой и образуют различные соединения. Они также могут перемещаться и сталкиваться друг с другом, создавая химические реакции. Такие реакции могут приводить к образованию новых атомов и молекул, а также к изменению свойств вещества.
Основной разницей между атомами и молекулами является количество атомов, из которых они состоят. Атом - это самая маленькая частица элемента, которая сохраняет его характеристики. Молекула же представляет собой группу атомов, связанных друг с другом, и может быть составной частью вещества.
Таким образом, молекула может быть больше или равной по размеру атому, так как она состоит из нескольких атомов. Однако, в общем случае, атомы являются более маленькими по размеру, чем молекулы.
Принципы составления атомов и молекул

Молекулы, с другой стороны, образуются при соединении двух или более атомов. Это происходит путем обмена или совместного использования электронов между атомами. Процесс образования молекул называется химической реакцией.
Химические элементы в периодической системе расположены по порядку возрастания атомного номера, что означает, что они имеют разное количество протонов в ядре атома, а следовательно, и разное количество электронов. Некоторые элементарные вещества, такие как гелий или неон, состоят только из одного типа атома и называются инертными газами, так как они практически не вступают в химические реакции.
Атомы более сложных веществ, таких как вода или кислород, соединяются в молекулы путем обмена или совместного использования электронов. Это происходит путем образования химических связей, которые могут быть ковалентными или ионными. Водные молекулы, например, состоят из двух атомов водорода, связанных с одним атомом кислорода.
Таким образом, можно сказать, что молекулы состоят из двух или более атомов, и поэтому по объему молекулы обычно больше, чем атомы. Однако, в зависимости от конкретной молекулы и атома, существуют различия в их размерах.
Масса атомов и молекул

Масса молекулы, с другой стороны, зависит от количества атомов, из которых она состоит, и их массы. Молекула, как правило, содержит два или более атомов, связанных химическими связями. Соответственно, масса молекулы будет превышать массу одного атома.
Если рассматривать атом и молекулу изолированно, то масса атома всегда будет меньше массы молекулы. Однако следует отметить, что сравнивать массу атома и массу молекулы напрямую некорректно, так как они имеют разные размеры и природу. Масса атома характеризует его внутреннюю массу и может быть измерена в атомных единицах массы (а.е.м.), где масса протона равна 1 а.е.м. Масса молекулы, с другой стороны, измеряется в атомных массовых единицах (аму), где масса одного атома равна примерно 1/12 массы атома углерода-12.
Важно отметить, что важность массы атомов и молекул не только связана с атомной физикой и химией. Масса атомов и молекул также играет роль во многих других областях науки и технологий, включая биологию, фармакологию, материаловедение и многое другое. Точное измерение массы атомов и молекул является важной задачей для понимания и управления различными процессами и реакциями в природе и технологиях.
Размеры атомов и молекул

Атомы:
Атомы являются основными строительными блоками вещества. Они представляют собой наименьшие частицы элементов, которые сохраняют их уникальные свойства. Размер атомов очень маленький и обычно измеряется в пикометрах (1 пикометр равен 1 триллионной доле метра).
На самом деле, размеры атомов могут значительно варьироваться в зависимости от элемента. Например, радиус атома водорода составляет примерно 0,053 пикометра, в то время как радиус атома урана составляет около 0,138 пикометра. Таким образом, атомы могут быть очень маленькими.
Молекулы:
Молекулы состоят из двух или более атомов, связанных химическими связями. Как и атомы, размеры молекул могут варьироваться в зависимости от их состава. Взаимное расположение атомов в молекуле и количество атомов в ней также влияют на ее размеры.
Общий размер молекулы велик, по сравнению с размером атомов. Например, размер молекулы воды составляет около 0,275 нанометра (1 нанометр равен 1 миллиардной доле метра), в то время как размер молекулы белка может достигать нескольких нанометров.
Таким образом, атомы составляют основу молекул, и их размеры обычно гораздо меньше, чем размеры молекул. Однако, необходимо учесть, что конкретные размеры атомов и молекул могут быть различными в зависимости от элементов или соединений, которые они образуют.
Структура атомов и молекул
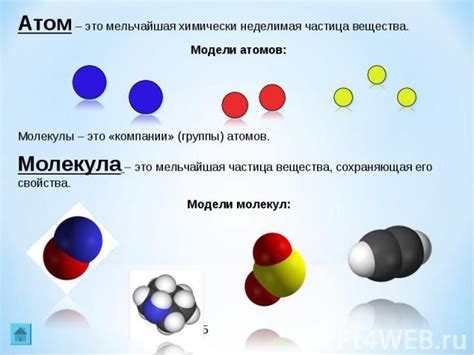
Протоны имеют положительный электрический заряд, нейтроны не имеют заряда, а электроны имеют отрицательный заряд. Все атомы состоят из разного количества протонов, нейтронов и электронов, и это определяет их химические и физические свойства.
Молекула, в свою очередь, представляет собой группу атомов, связанных друг с другом химическими связями. В молекулах атомы объединяются в различные комбинации, образуя различные вещества. Например, водные молекулы состоят из двух атомов водорода и одного атома кислорода, связанных ковалентными связями.
Молекулы могут быть одноатомными, то есть состоять только из одного вида атомов, или многоатомными, где атомы разных элементов объединяются. Примером одноатомной молекулы может быть молекула кислорода (O2), состоящая из двух атомов кислорода. Примером многоатомной молекулы может быть молекула воды (H2O), состоящая из двух атомов водорода и одного атома кислорода.
| Тип | Описание |
|---|---|
| Атом | Наименьшая единица элемента, состоящая из ядра и электронной оболочки. |
| Молекула | Группа атомов, связанных химическими связями. |
| Протоны | Атомные частицы с положительным зарядом, находящиеся в ядре. |
| Электроны | Атомные частицы с отрицательным зарядом, находящиеся в электронной оболочке. |
| Нейтроны | Нейтральные атомные частицы, находящиеся в ядре. |
Интермолекулярные силы
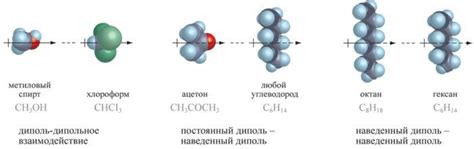
Интермолекулярные силы возникают благодаря взаимодействию между диполями, атомами или молекулами. Они делятся на несколько типов: диполь-дипольные силы, дисперсионные силы и водородные связи.
Диполь-дипольные силы возникают между молекулами, у которых есть постоянные или временные диполи, т.е. неравномерное распределение электрического заряда. Это происходит, например, когда одна молекула содержит атомы с большей электроотрицательностью, чем другая. Диполи притягиваются друг к другу, создавая слабое взаимодействие между молекулами.
Дисперсионные силы возникают благодаря неравномерному распределению электронов в молекуле. В любой молекуле временно образуются небольшие диполи, которые взаимодействуют со схожими диполями в соседних молекулах. Это создает притяжение между молекулами и стабилизирует вещество.
Водородные связи возникают между молекулами, содержащими атомы водорода, связанные с атомами кислорода, фтора или нитрогена. Водородные связи являются особенно сильными и играют важную роль во многих биологических и химических процессах, таких как образование ДНК или воды.
Интермолекулярные силы сильнее дисперсионных сил, но слабее водородных связей. Влияние этих сил на свойства вещества можно наблюдать, например, при изменении температуры или давления. Понимание и изучение интермолекулярных сил позволяет лучше понять многие физические и химические явления в природе.
Участие атомов и молекул в химических реакциях

В химической реакции атомы и молекулы вступают во взаимодействие друг с другом, образуя новые связи. В ходе этого процесса, атомы и молекулы могут либо собираться вместе, либо распадаться на составляющие их частицы. Важно отметить, что в химической реакции отдельные атомы не могут существовать в свободном состоянии, они всегда связаны с другими атомами.
Молекула - это наименьшая единица вещества, которая сохраняет его химические свойства. Она состоит из двух или более атомов, связанных между собой химическими связями. Атомы, в свою очередь, являются основными строительными блоками молекул и представляют собой наименьшие единицы химических элементов.
В противоположность молекуле, атомы не могут существовать независимо и особняком, они всегда вступают во взаимодействие с другими атомами для формирования молекул и структурных единиц вещества.
Процесс химической реакции, в котором происходит восстановление, синтез или разрушение химических связей, позволяет атомам и молекулам изменять свою конфигурацию и образовывать новые вещества с различными химическими свойствами.
Таким образом, участие как атомов, так и молекул в химических реакциях является необходимым условием для изменения структуры и состава вещества, а также для образования новых веществ.



